 🏠
🏠
 🏠
🏠

この「アルミニウム電解槽」は、昭和電工(株)大町工場に設置され 1 ) 、 昭和9年(1934年)1月11日、国産初の「アルミニウム」を生産したわが国最初の 「電解槽」 を、 当時のままに実物大に再生したものです。 大町市は、この 「電解槽」 から生産された国産アルミニウムにより、「アルミニウム発祥の地」の栄誉を、永遠に記録されることとなりました。
物質に電気を流すことで、撹拌、加熱、加圧などで得られなかった新たな材料を作ることができます。 物質に通電するための仕組みの単位を、電解槽、セルといいます。 セルには電極があり、通電するだけでなく電気を取り出すのにも使います。この場合はセルを電池と呼びます。 セルをいくつか直列につないで、電気エネルギーを取り出せるようにしたものはバッテリーと呼びます。

てのひらに、10円と1円をのせれば、 電気化学の三要素 がそろって、電池になります。 デジタル式回路計で、 電圧を測定すると、0ではありません。 これが 電池の起電力です。 電流が流れていないにもかかわらず電圧があるのです。 電池では、電流と電圧が、そのまま比例しません。 電池は単なる電気抵抗ではないのです。 化学反応が電気を起こしているのです。 11円電池は、 ガルバニ電池と言っていいでしょう。
コイン電池の電位の高い方を正極と言います。電位の低い方を負極と言います。 十円玉と一円玉の正極はどちらでしょう?
手のひらにのせた十円玉と一円玉が接触すると、起電力はなくなります。 この状態を短絡、ショートと言います。 電位の高かった十円玉から、電位の低かった一円玉に電流が流れています。 一円玉から手のひらの汗に電流が流れ込み電気分解が起きます。
コインの電位序列を回路計で実測し、数直線に記入しましょう。 数直線の描画
物質量n〔mol〕と 電気量n〔C〕 は比例します。これを ファラデーの電気分解の法則と言います。 比例定数はファラデー定数F=96485.3415〔C/mol〕です。
ファラデーの法則を使って電気量を測る装置を クーロメーターと言います 8 ) 。 銀クーロメーター 9 ) 、 1936年の レイリー型電流天秤 10 ) を経て、現在の電気基準になりました。 産業界では、実用上、ツェナダイオード電圧標準器と標準抵抗器を標準としています。
96485.332 〔 C/mol 〕 は、アボガドロ数×電気素量で、それらはSIで定められた 定義定数 です。
工業的には、 26.801 〔 Ah/mol 〕をよく使います。
ファラデー定数は、 エネルギー密度や理論容量の計算にも使います。
一対の電極を備え電解質を支える一組をセルと言います。 工業電解では電解槽、エネルギーデバイスでは電池、研究用では電気化学セルなどと言います。 電気エネルギーを取り出す目的でセルを複数つないで構成したものはバッテリーと言います。
電気化学系の最小単位は、一つの電子伝導体Mと一つのイオン伝導体Sの接触によって構成されます 11 ) 。
電解質は、電子絶縁体です。 電池で、電子絶縁破壊が起きると、電気分解です。 コンデンサでは、電子絶縁体は、誘電体です。
| 分類 | 種類 | 備考 | |
|---|---|---|---|
| セル(単電池) | 二極式 フルセル | 実用電池(コインセル、円筒型電池)、メッキ試験(ハルセル)、電解槽など。 アノード、 カソードのみ | |
| 三極式 ハーフセル | 作用極 、対極、 参照極 | ||
|
バッテリー(組電池) 電解槽 |
単極式(モノポーラ) | ||
| 複極式(バイポーラ) | 液を通しての短絡電流を防ぐなどの工夫が必要となる。 トヨタ 古河電池 |
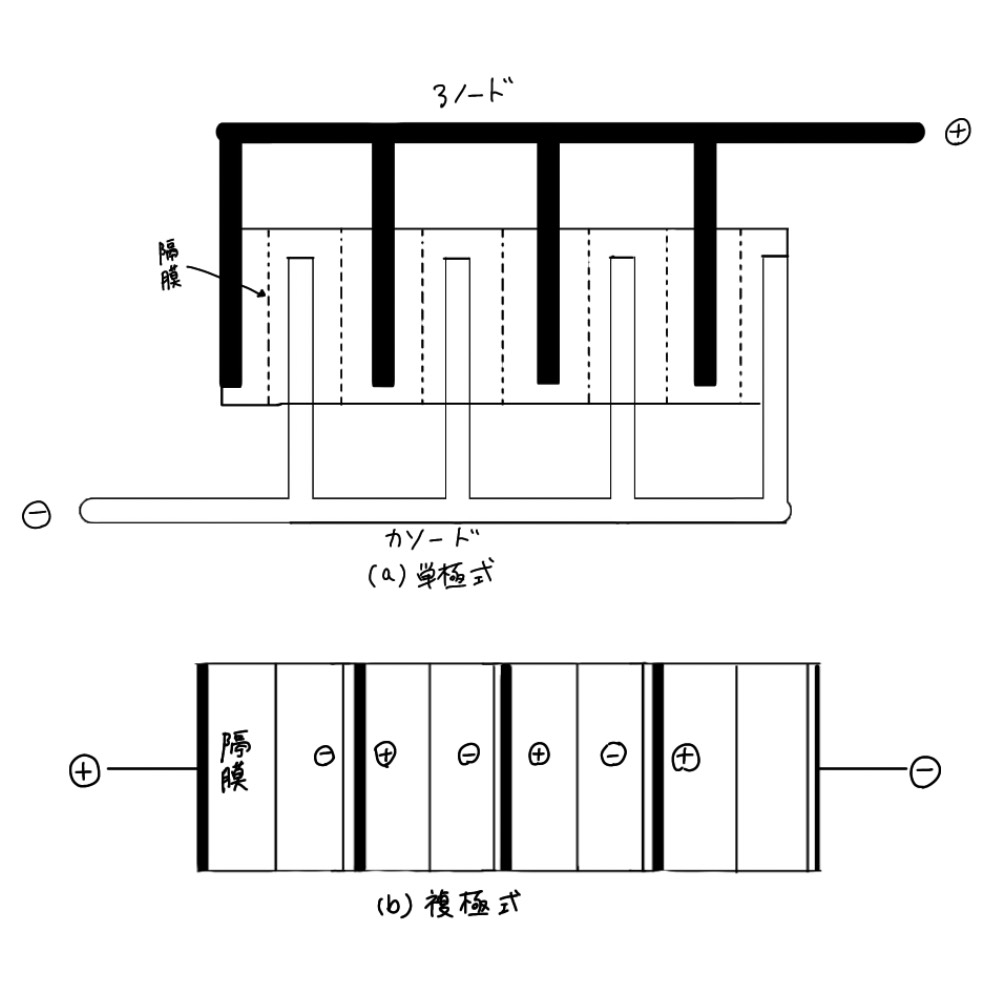 図
5
.
電極の接続様式
図
5
.
電極の接続様式
バイポーラ接続では、ブスバーなどの重量を低減できるため、 バッテリーだけでなく、 水電解の電解槽などでも、応用が考えられるが 液絡のリスクを減らすのが課題です。 12 )

平行平板電極であれば、
セル定数a=電極間距離d÷セル断面積S
です。
一般的には、導電率既知のKCl溶液などを使って、セル定数を較正します。
コンダクタンス=導電率
電気抵抗=抵抗率×長さ÷電極面積
化合物を表すのに化学式を使います。化学式には組成式やイオン式などがあります。 同様にセルの構成を表すのに電池式を使います。
一般に、電気の流れる向きを、横書き文字と同じように左から右に書くと読みやすいため、 左にアノード、右にカソードを書きます。 一次電池の場合は、左が負極、右が正極となります。
電池式では、 界面を縦棒(|)で表します。
| 化学種 | 式 | 式の種類 | 例 |
|---|---|---|---|
| 水素 | 元素記号 | H | |
| 水 | 分子式 | H2O | |
| 水 | 電子式 | H:O:H | |
| 水 | 示成式 | H-O-H | |
| 水 | 構造式 | H-O-H | |
| 水素分子 | 分子式(化学式) | H2 | |
| 硫酸アルミニウム | 組成式(化学式) | 3Al2(SO4)3 | |
| 炭酸イオン | イオン式(化学式) | CO32- | |
| アルミン酸イオン | イオン式(化学式) | [Al(OH)4]- | |
| 蛍光体 | 賦活 | (Cr,Ca,Ba,Mg)5(PO4)3Cl:Eu3+ | |
| クレーガー=ビンクの表記法 | ショットキー欠陥 | null⇔2VAl'''+3VO・・ | |
| クレーガー=ビンクの表記法 | フレンケル欠陥 | OO×⇄Oi''+VO・・ | |
| ダニエル電池 | 電池式 | Zn | Zn2+ || Cu2+ | Cu |
化学式には、組成式、構造式、示性式、電子式などがあります。 欠陥 には、クレーガー=ビンクの表記法が使われます。 デジタル情報としては、 SMILES記法などがあります。 また伝統的なファイル形式として、mol形式などがあります。 XML形式としては、CML形式などがあります。
化合物を化学式で表すように、電解槽・電気化学セル・電池を表すには電池式があります。電池式はアノードを左側に書くのが慣例です。 電池式の縦棒(|)は相と相との界面を表しています。たとえばダニエル電池の電池式は下記のようになります。 電池の起電力の測定では、電池式からダニエル電池を組み立てることになります。
ガルバーニ電池、 ボルタ電堆、 ダニエル電池と発展します。
ダニエル電池では、正極も負極もカタチが変形するのです。 しかも、カタチの変形が可逆でないのです。 可逆でないカタチの変形は、充電式電池(二次電池)にとって、致命的です。
| 電池系/電解系 | 電池式 | 備考 | |
|---|---|---|---|
| ダニエル電池 | Zn | Zn2+ || Cu2+ | Cu | ||
| リチウムイオン二次電池 | Cu|C6Li|LiPF6 EC+DEC|□CoO2,C|Al | ||
|
銅の電解精錬 /銅めっき / 銅クーロメーター |
Cu|CuSO4aq|Cu | ||
|
アルミニウムの アノード酸化 |
Al| Al2O3 | NH4OOC(CH2)4COONH4 aq | ||
| 銀のアノード酸化 | Ag|AgCl|HCl aq |
電池式では、 界面を縦棒(|)で表します。
| 電池式 | Zn | ZnSO4aq || CuSO4aq | Cu |
| 負極 反応 | Zn2+ + 2e- ← Zn Eº = -0.7626V |
| 正極 反応 | Cu2+ + 2e- → Cu Eº = 0.34V |
| 全反応 | Zn +Cu2+ → Zn2+ + Cu |
| 起電力 | e.m.f. = 1.1026V |
| 理論容量 ( 電力原単位 ) | 415.7mAh/g |
| 理論重量エネルギー密度 14 ) | 458.4mWh/g |
起電力は、電解液中の亜鉛イオンと銅イオンの活量が1であるとしたときの起電力です。 関与する化学種の活量を全て1としたとき、起電力は、酸化還元電位の差になります。
*| 注目する量 | 電極の名称 | 説明 |
|---|---|---|
| 電位 に注目 | 正極 | 電位の高い電極、(+)プラス。 正極活物質 は、電池放電時に、酸化剤。 |
| 負極 | 電位の低い電極、(-)マイナス。 負極活物質 は、電池放電時に、還元剤。 | |
| 電流に注目 | アノード | 電流が流れ込む電極。酸化反応が起きる電極。 放電するときは負極。 充電式電池では、充電のときは正極。 |
| カソード | 電流が流れ出る電極。還元反応が起きる電極。 放電するときは正極。 充電式電池では、充電のときは負極。 |
電池には電極があります。酸化が起きる極をアノード、還元が起きる極をカソードと呼びます。 以前はアノードを陽極、カソードを陰極と呼びましたが、正極と陽極がまぎらわしいのでアノードと呼びます。 アノードは電流が外部回路から流れ込む極です。カソードは電流が外部回路へ流れ出す極です。 アノード、カソードは電流の向きに注目した呼び方です。 それとは別に正極と負極という呼び方があります。 電位の高い極を正極、電位の低い方を負極と呼びます。 正極、負極は電位の高低に注目した呼び方です。
電池には電極があります。
酸化が起きる極をアノード、還元が起きる極をカソードと呼びます。 以前はアノードを陽極、カソードを陰極と呼びましたが、正極と陽極がまぎらわしいのでアノードと呼びます。 アノードは電流が外部回路から流れ込む極です。カソードは電流が外部回路へ流れ出す極です。 アノード、カソードは電流の向きに注目した呼び方です。 それとは別に正極と負極という呼び方があります。 電位の高い極を正極、電位の低い方を負極と呼びます。 正極、負極は電位の高低に注目した呼び方です。
ダニエル電池を放電するときは、負極の亜鉛が酸化して亜鉛イオンになります。 つまり負極がアノードです。 乾電池の負極も亜鉛です。 乾電池に豆電球をつないで点灯させているときも亜鉛が亜鉛イオンとなって溶け出していることになります。
無機工業化学・電気化学に記載されている電池をひとつ選び、その電池式を書きなさい。電池式の上に、その電池が放電しているときの回路図を書き、回路図に電極の呼び名も記入しなさいその図面を撮影してアップロードしなさい。
豆電球のスペックをみたところ、2.5Vの0.5Aでした。 このとき亜鉛が溶け出す反応速度をmol/sで求めてみましょう。
電極がアノードとカソードのふたつだけの電気化学セルを2極式セルと言います。 2極式セルは電解液やセルの寸法の影響を受けやすいので、 特定の反応だけ見る場合は、3極式セルを使います。 3極式では、電位が予めわかっている参照電極を使います。
特定の反応が起きている電極を参照電極を使って平衡電位を調べるとき、その電極を単極と言い、半電池と言います。電解液がまざらないよう塩橋でつなぎます。これを液絡と言います。
| 例 | 備考 | |
|---|---|---|
| 白金電極 | 水素過電圧が小さい | |
| 金電極 | 酸素過電圧が大きい | |
| カーボン電極 | ||
| 水銀電極 | 水素過電圧が大きい | |
| その他の金属電極 | ||
| 特殊な電極 | ネサ電極(透明電極) | ITO電極、FTO電極はディスプレイに使われる * |
ITOは、 酸化インジウム(III) (In2O3) と酸化スズ(IV) (SnO2) の無機混合物です。
| 例 | 備考 | |
|---|---|---|
| 銀|塩化銀電極 | AgCl + e- ↔ Ag + Cl- Eº = 0.2223V* | 温度、 Cl-濃度に依存 |
| 水銀|塩化水銀電極 | Hg2Cl2 + 2e- ↔ 2Hg(l) + 2Cl- Eº = 0.26816V * | 温度、Cl-濃度に依存 |
| 水銀|酸化水銀電極 | HgO + H2O + 2e- ↔ Hg(l) + 2OH- Eº = 0.0977V * | アルカリ用(アルカリ電池の研究、粘土分散液の研究)、温度、OH-濃度に依存 |
| 水銀|硫酸水銀電極 | Hg2SO4 + 2e- ↔ 2Hg(l) + SO42- Eº = 0.613V * | 酸性用(鉛電池の研究、二酸化マンガンの電解合成の研究)、温度、SO42-濃度に依存 |
参照電極の例として銀塩化銀電極について調べ、銀塩化銀電極を参照電極として亜鉛亜鉛イオン電極と半電池を組み立てたときの電池式を書き、電位を測定するための実態配線図を書きなさい。
塩橋には、アニオンとカチオンの輸率が近しい 塩化カリウム水溶液などが使われます。
電気回路は電池の中で途切れているわけではありません。 電池の中で電流はイオンとしてアノードからカソードへ流れます。 電解液の中のイオンは 電界 E 〔V/m〕 によって 力 F 〔N〕 を受けるからです。 このようにイオンが力を受けて移動する道筋を電気力線といいます。 電気力線は途中で途切れることもなければ交わることもありません。
同じ電解液であれば、抵抗は電極間距離に比例し、断面積に反比例します。 このときの電極間距離と断面積の比をセル定数aと言います。
| 物理量 | 単位 | 凡例 |
|---|---|---|
| 電極間距離 d | m | 電界の強さ=電圧÷電極間距離 |
| セル断面積 S | m² | 拡面倍率1で、平板モデルのとき電極面積≒セル断面積 |
| 電極面積 A | m² | 実験室でよく使う旗型電極の電極面積は 1cm²。 |
| セル定数 a | 1/m |
セル定数a=電極間距離d÷セル断面積S コンダクタンス G = 導電率 σ ÷セル定数 電気抵抗=抵抗率ρ×セル定数a |
| バルク電流密度j | A/m2 | バルク 電流密度 j = 電流I÷セル断面積 |
| 界面電流密度j | A/m2 | 界面 電流密度 j = 電流I÷電極面積 |
| 電界の強さe | V/m | 電界の強さe = 電圧V÷電極間距離 |
電線では、オームの法則は、「電圧〔V〕=電流〔A〕×電気抵抗〔Ω〕」で、表されます。 だから、電線では、入口と出口の電圧差と電線の電気抵抗がわかれば、流れる電流がわかります。
電池や電解槽の中では、電位の高いところから、低いところに、電流が流れます。 それは、まるで高気圧から低気圧に風が吹くようです。 電池や電解槽の中では、オームの法則は、「電場強度(電界の強さ)〔V/m〕=電流密度〔A/m2〕×抵抗率〔Ωm〕」で、表されます。 天気図で等圧線が混んでいるところは激しく風が吹くように、等電位線が混んでいるところは、電流密度が大きくなります。
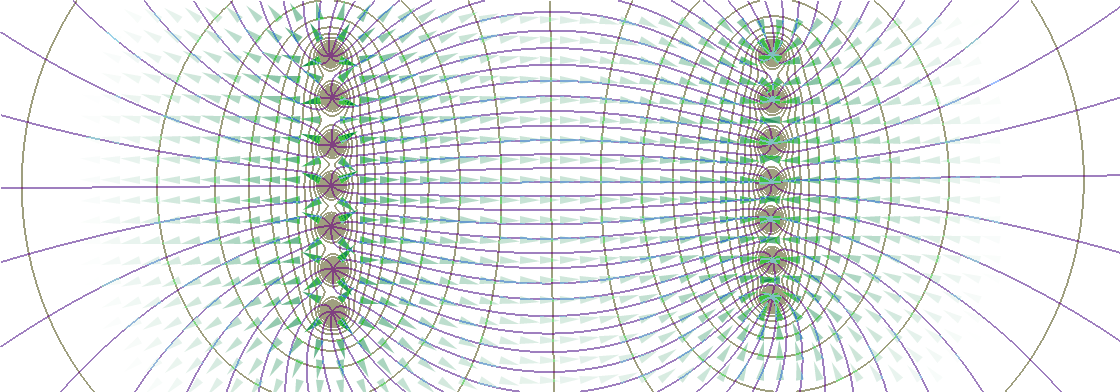
等電位線(等電位面)は、平面上(空間中)の電位の等しい点をつないだ線(面)です。 等電位線は、気象の天気図の等圧線、地図の等高線と同じ概念と思ってさしつかえありません。
大きな平行板電極を小間隔で向かい合わせると、電界の強さおよびその方向が、均一になります。 これを平等電界と言います。 でも、板の端の部分では電界が両電極板の外側に出る形になり平等電界ではなくなります。 この現象を端効果たんこうか(縁効果えんこうか)と言います。 https://em.ten-navi.com/dictionary/1763/
# ■■■ 等電位線と電気力線 ■■■
import numpy as np
import matplotlib.pyplot as plt
# 静電ポテンシャル
def phin(x, y):
z = 0; u = 0.02; x_off=2.02
for y_off in np.arange(-2,2,0.1):
z = z - u /np.sqrt((x-x_off)**2 + (y+y_off)**2) \
+ u/np.sqrt((x+x_off)**2 + (y+y_off)**2)
return z
# 規格化された電場ベクトル
def hEnx(x, y):
dx = 0.01; z = (phin(x+dx,y)-phin(x-dx,y)) / dx / 2
return z
def hEny(x, y):
dy = 0.01; z = (phin(x,y+dy)-phin(x,y-dy)) / dy / 2
return z
# グラフのサイズ
fig = plt.figure(figsize=(6.4, 6.4))
# 枠と縦軸目盛を非表示に
ax = fig.add_subplot()
ax.axis('off')
# 電場ベクトルの始点
x = y = np.linspace(-5.5, 5.5, 12)
x, y = np.meshgrid(x, y)
# 電気力線を描く
plt.streamplot(x, y, hEnx(x, y), hEny(x, y),
broken_streamlines = False,
density=0.3,
zorder = 0,
color = 'tab:blue');
# contour の meshgrid
delta = 0.1
xrange = np.arange(-6, 6, delta)
yrange = np.arange(-6, 6, delta)
x, y = np.meshgrid(xrange, yrange)
# 等電位面を描く
cont=plt.contour(x, y, phin(x, y),
# 等電位線を描く phi(x, y) の値のリスト
[-0.5, -0.4, -0.3, -0.2, -0.1, 0,
0.1, 0.2, 0.3, 0.4, 0.5],
# 等電位線の色,今回は全て同色に
colors=['lightgreen']*8);
# ■■■ 等電位線 ■■■
電池 は、 アノード、 カソード、電解質の 三要素 からなります。 電池で起きる現象は、 電解質などの バルクの現象、 アノードやカソードといった電極と電解質の 界面の現象に、分けられます。
界面を表す 特性とバルクを表す 物性があります。等価回路ではときどき不明瞭なものがありますので、単位で確認しましょう。
たとえばバルクの測定をメインにする導電率測定の導電率計では、 界面インピーダンスを下げるため、電極に300倍もの拡面倍率を持つ白金黒電極を使います。
|
計測可能
な
物理量
(セル) |
界面
の特性値 (面積) |
バルクの
物性値
(セル定数) |
|---|---|---|
|
電気抵抗
R[Ω]
=電圧÷電流
,
|
反応抵抗(面積抵抗率)
Rct〔Ωm-2〕
=電圧÷ 表面 電流密度 接触抵抗 (界面抵抗) * =電圧÷表面電流密度 |
抵抗率(体積抵抗率)ρ
=電場強度e÷ 断面 電流密度 抵抗率ρ〔Ωm〕=電気抵抗R〔Ω〕÷ セル定数 a〔1/m〕 電気抵抗R=抵抗率ρ×長さl/面積S 17 ) 抵抗率ρ=1÷導電率 |
|
コンダクタンスG[S]
=1÷電気抵抗R |
導電率
σ(
|
|
|
静電容量
(キャパシタンス)C
,
|
電気二重層容量Cd〔Fm-2〕 |
誘電率
=電荷密度÷ 電場強度e |
|
インダクタンスL
,
|
透磁率 μ |
電池の内部抵抗は、 バルク抵抗だけでなく、界面抵抗に左右されます。 溶液に金属を浸しただけの ダニエル電池 のような単純な電池では、バルク抵抗が支配的ですが、 合材電極や固体電解質を使う リチウムイオン電池 のような複雑な電池では、界面抵抗が支配的です。 電池の内部抵抗の評価には、 交流評価と直流評価を組み合わせが必要です。
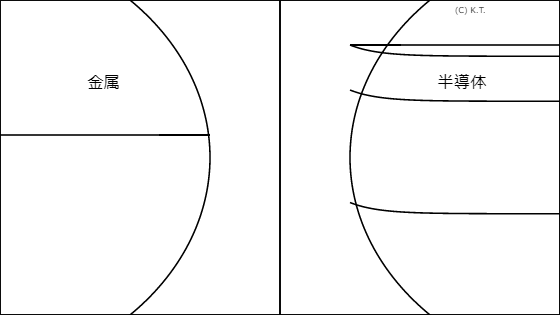
| 固体 | 液体 | 気体(真空) | |
|---|---|---|---|
| 固体 |
面接触(例:
pn接合) 線接触(三相界面)(例:正極合材、 局部電池) 点接触(三相界面 ショットキー接触 )(例:固体電解質、 炭素導電助剤粒子 ) |
固液界面 (例:サスペンジョン) | 表面 |
| 液体 | 固液界面 (例:電極と電解液) | 液液界面 (例:エマルション) | 気液界面 ( 表面 ) |
| 気体(真空) | 表面 | 気液界面 ( 表面 ) | (混合) |
物質は、 様々な状態をとります。 界面や表面 は、ある材料の相と異なる材料の相が接するところです。
電池の内部抵抗は、バルクと界面との両方から生じます。

空間電荷層を含みます。
セルは寸法が大切なので、三角法で製図しましょう。

銅めっき 米沢高等工業学校本館から 銀電量計を探してみよう。
アノードもカソードも銅だったら、理論分解電圧は何Vになるか?