 🏠
🏠
 🏠
🏠
化学実験Ⅰのエネルギー化学分野は、2024年度より 化学実験Ⅱとして開講されます。
銅電極と亜鉛電極を作り、塩橋でつないでダニエル電池を組み立て、電位差計でダニエル電池の起電力を確かめます 1 ) 。 次に銀塩化銀電極作り銅電極と亜鉛電極の単極電位を電位差計で確かめます。 混合比を変えた鉄イオン(Ⅱ)と鉄イオン(Ⅲ)の溶液を作り、白金を作用極として、銀塩化銀電極に対する電位を測り濃度比の対数に対して電位をプロットし、ネルンストの式に従うかどうか確かめます。
電圧を測るということは、 電圧を長さに変換 してノギスやモノサシを当てることです。高校物理や エネルギー化学 で習った電位差計(ポテンショメーター)を覚えていますか?
電池の起電力 は電流を流さずに測定せねばなりません。そのための工夫を理解した上で、まずはダニエル電池の起電力 E〔V〕を測定しましょう。次に参照電極として銀塩化銀電極を使って単極電位を測定しましょう。最後に活物質の体積モル濃度 M〔mol/m3〕を変えてネルンストの式が成り立つをことを確認しましょう。
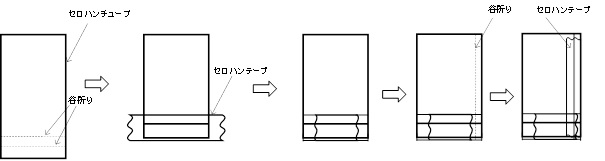
塩橋(ソルトブリッジ)とは、液の混合を防ぎつつイオンを通す部品です。液絡とも言います。 一番簡単なのは、電解液で湿らせたろ紙を使うことです。 昔の高校の化学の教科書では電解液を寒天で固めたものが紹介されていました。 現在の高校の化学の教科書ではセロハンチューブを使った方法が紹介されています。 セロハンチューブは ツールボックス に入っています。
先生:「
まずはあの
エジソン蓄音機
にも採用された
ダニエル電池
を作ろう。ダニエル電池は隔膜、つまりセパレータが採用された画期的な電池だ。さて硫酸銅と硫酸亜鉛はどこいったっけ?」
学生:「あそこの試薬だなです」
先生:「セロハンを隔膜に使おう」
学生:「セロハン?」
先生:「硫酸銅と硫酸亜鉛の水溶液が混じりあわないようにね」
学生:「なるほど」
先生:「隔膜、セパレータには素焼きの器を使うほか、液絡として寒天、ガラスフリットなどいろいろあるね」
学生:「そいうの、塩橋って言うんですよね!」
先生:「よく知ってるね!リチウムイオン二次電池のセパレータには温度でシャットダウンする多孔質フィルムが使われるんだよ」

ダニエル電池の 電池式 は下記のとおり。
Zn | Zn2+ || Cu2+ | Cu 式 ( * )
( Zn | 0.01 mol・dm-3 ZnSO4 || 0.01 mol・dm-3 CuSO4 | Cu )
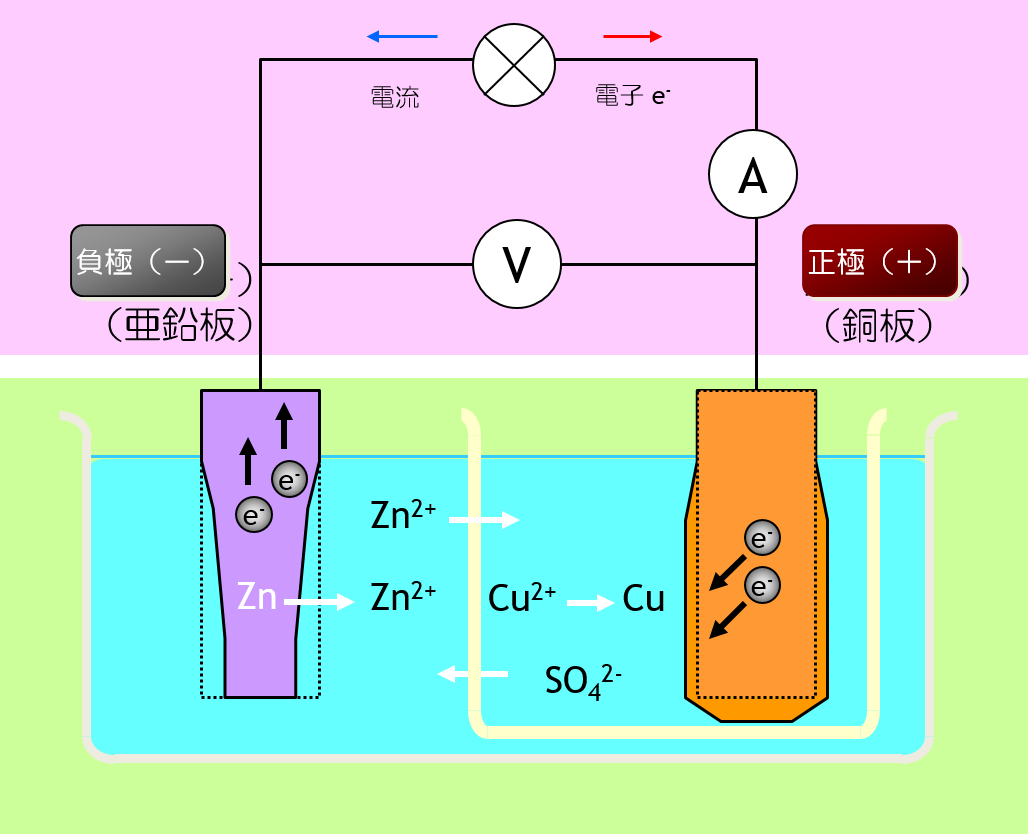
| 電池式 | Zn | ZnSO4aq || CuSO4aq | Cu |
| 負極 反応 | Zn2+ + 2e- ← Zn Eº = -0.7626V |
| 正極 反応 | Cu2+ + 2e- → Cu Eº = 0.34V |
| 全反応 | Zn +Cu2+ → Zn2+ + Cu |
| 起電力 | e.m.f. = 1.1026V |
| 理論容量 ( 電力原単位 ) | 415.7mAh/g |
| 理論重量エネルギー密度 3 ) | 458.4mWh/g |
起電力は、電解液中の亜鉛イオンと銅イオンの活量が1であるとしたときの起電力です。 関与する化学種の活量を全て1としたとき、起電力は、酸化還元電位の差になります。
*
「ダニエル電池が組みあがったら、早速電圧を測定してみよう」
「最近のテスターは入力インピーダンスが大きいから簡単に電圧測定できるね」
「時間にゆとりがあったらダニエル電池を2個直列にしてLEDを点灯させてみよう」
「2個直列につないだときの電圧が2.07Vです」
「ダニエル電池の起電力のほぼ2倍だね。LEDを点灯したときの電圧は?」
「1.77Vです」
「100Ωの両端の電圧は?」
「0.01Vです」
「ということは回路に流れている電流は?」
「0.1mAです」
「電池の内部抵抗が求まるね?」
「なるほど3kΩです」


ダニエル電池は電池なのか?
 回答
回答
先生:「ウェストン電池は1.013Vの電圧の基準だったよ。でも、横にすると液が漏れるなど問題もおおい。」
先生:「ICを使えば、液もなく、安定した電圧を得られる時代になった。ICを使った基準電圧源を作ろう。」
学生:「ICって,あのケータイ電話にはいっている四角に蠏さんの足がついているものね」
先生:「今回の心臓部は、REF02CPZで,精度が 5.0±0.0015V,温度が変わっても1度あたり8.5ppmしか変化しない優れものだよ.
それでいて,お値段が400円ときた.」
学生:「でも,5Vなんでしょう.1Vにしたいな.」
先生:「中学校で習った抵抗の直列繋ぎを応用して,同じ抵抗を5本つないで,1つの抵抗の両端で電圧は,5分の1になる.」
学生:「ふむふむ,思い出した.なんだぁ,それだかぁ.」
先生:「みなさんの先輩の今井直人くんが,基準電源の作り方のテキストを書いてくれたので,それを見ながら作ってください.」
先生:「このテキストを元に,大前くんが,実際に作ってみたようです.」
大前:「ブレッドボードは繋ぎ方がわかんねーよ.どうつながっているの?テスターで導通確認をして使えばいいだよ.」
かつて電圧の 測定標準 4 ) として、 ウエストン電池 5 ) などが使われました。 半導体が使われるようになり 定電圧源 として利用できます。
基準電圧ICは、回路に一定の電圧の直流を供給するために用いられる電子部品です * 。 基準電圧ICから出力された5Vを抵抗分割して1Vとし、 それを オペアンプ 6 ) を使ったボルテージフォロアロアで出力しています。
回路図は、電気用図記号で表現されます。
先生:「これが標準電池だ。さっそく内部を見てみよう」
学生:「赤い物質や黄色い物質がH字型のガラス管に入れられていますね」
先生:「このH字型のガラス管が作れたら、ガラス細工の腕もまあまあなんだがね・・・」
学生:「自作できるんですか?・・・いやあ、ガラス細工もやってみたいす」
先生:「まずはともあれカドミウム標準電池、別名ウエストン電池、20℃で1.0183ボルト」
V=1.0183+0.00004(20-t)
先生:「温度係数が非常に小さい。不飽和型のウエストン電池というのもあってこちらは1.0186ボルトで温度のほとんど無関係*」
学生:「ふへえ、安定しているんですねえ」
先生:「これが電圧の基準になるんだから、横にしたりしないようにね!」
学生:「はい!」
先生:「抵抗尺を使って電位差計を組み立てる。抵抗尺上に長さに比例した電位が生じるように電池をつなぐ。」
学生:「電位差計?」
先生:「英語だったらポテンショメーター。」
学生:「はい!」
先生:「抵抗尺の一方の端を電位の共通の電位基準としてつなぐ。標準電池を使いたいところだけど壊れやすいのと数がないのでICを使った基準電源を標準電池として使おう。」
学生:「はい!」
先生:「検流計を介して標準電池と抵抗尺をつなぎ、電流が流れない場所を探し出す。電流がながれないということは電位が等しいということ。つまりそのときの長さに相当するのがダニエル電池の起電力というわけだ。」
銀塩化銀電極は、 第二種電極に分類され、中性電解液中での参照電極(比較電極とも呼ばれます)に使われます。pH計などに応用されます。
| 例 | 備考 | |
|---|---|---|
| 銀|塩化銀電極 | AgCl + e- ↔ Ag + Cl- Eº = 0.2223V* | 温度、 Cl-濃度に依存 |
| 水銀|塩化水銀電極 | Hg2Cl2 + 2e- ↔ 2Hg(l) + 2Cl- Eº = 0.26816V * | 温度、Cl-濃度に依存 |
| 水銀|酸化水銀電極 | HgO + H2O + 2e- ↔ Hg(l) + 2OH- Eº = 0.0977V * | アルカリ用(アルカリ電池の研究、粘土分散液の研究)、温度、OH-濃度に依存 |
| 水銀|硫酸水銀電極 | Hg2SO4 + 2e- ↔ 2Hg(l) + SO42- Eº = 0.613V * | 酸性用(鉛電池の研究、二酸化マンガンの電解合成の研究)、温度、SO42-濃度に依存 |
| 銀線 | 作用極 | |
| 3M HNO3 | 濃硝酸をイオン交換水で希釈し細口ポリ瓶に保存、揮発性なので希釈の際はドラフトを使用 | |
| 0.1M HCl | 濃塩酸をイオン交換水で希釈し細口ポリ瓶に保存、揮発性なので希釈の際はドラフトを使用 |
電気化学セルを組み立てて銀線を塩酸中でアノード酸化して1本だけ作ります。その作り方は次の通りです。
銀線を紙やすりで研磨し、清浄な金属面を露出させます。その金属面を3M HNO3で前処理し、水洗いします。
その電極で以下のセルを作成し、
ノギスを使って銀電極の
寸法
を測り、
面積を求め、求めた電極面積から、電流密度 J=0.8mA/cm2となる電流 I〔A〕の値を求める。
求めた電流を抵抗尺の長さを操作して通電する、15分ほど電解(通電)して、表面に塩化銀を析出させます。電解セルには10mLビーカーを使います。転倒防止のため電解液を注ぐ前に底に両面テープを貼っておき、電解液を注ぎ終わったビーカーは実験台にしっかり固定します。電極はダブルクリップで固定します。 同じ手順でもう1本作成する。
Ag | 0.1 mol·dm-3HCl | Pt
反応式
AgCl+e-↔Ag++Cl- E=+0.22V
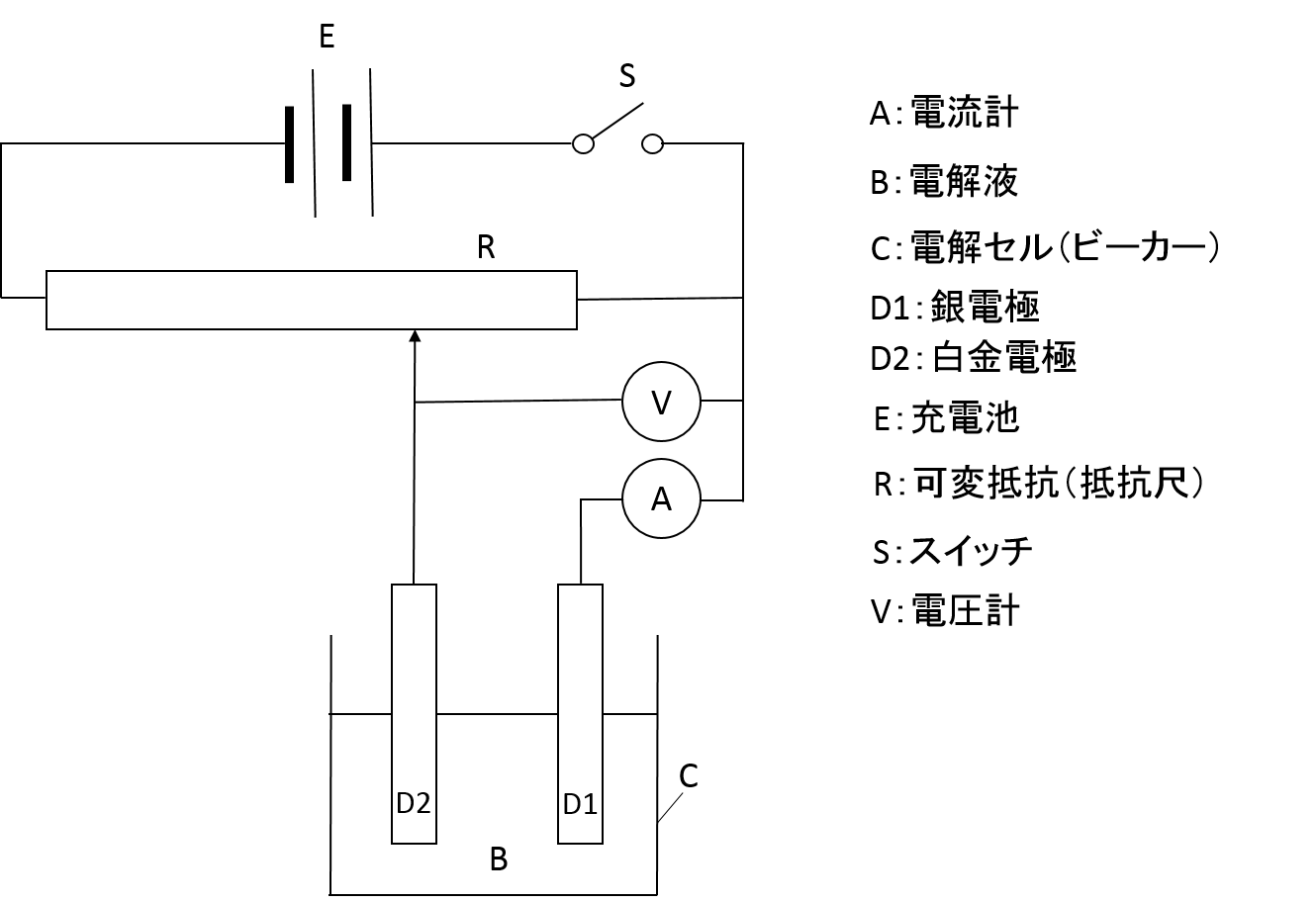
→参考書:電気化学測定法(上)技報堂出版、p97「銀|塩化銀電極の作り方」
→参考書:電気化学測定法(上) 技報堂出版、p96「新しく作った電極の電位チェック」
→参考書:電気化学測定法(上) 技報堂出版、p94「塩橋の作り方」
2本の電極を飽和KCl溶液(KClがビーカーの底に沈んでるくらいの溶液、濃度計算とか今は気にしなくていいよ。)に浸漬し下記のような電池を作成し、電位差(両端の電位)を測定し、デジタルテスターで確認する。電位差が5mV以内であることを確かめる。
もし、2本の電極電位が5mV以上ある場合は、うまく出来ていないと思われる方を作成しなおし、電位差が5mV以内になるまで繰り返す。
10mLビーカーを2個用いて塩橋で接続する。
塩橋にはシリコンゴム管もしくはセロハンチューブを用いる。シリコンゴム管を使用する場合は、煮溶かした電解質-寒天溶液を専用スポイトで吸い上げて固め、ゴム管の両端をカットする。(駒込ピペットは使わない、寒天が詰まるので注意) 使用済みのマッチ(マッチの燃えさし)は,その辺に置かずに,燃えさし入れに入れる。

セロハンチューブを使用する場合はページ上(ダニエル電池の組み立てと塩橋)を参照。
Ag | AgCl | KCl || KCl | AgCl | Ag (※ ||=塩橋)

ネルンストの式を用いてできるだけ正確にダニエル電池の起電力を計算する(Ref:エネルギー化学).
ECu-EZnが作成した電池の起電力。
E0Cu-E0Znが理論的なダニエル電池の起電力となります。理論的な起電力は何Vでしょう?
以下のダニエル電池を作成し*1)、標準電池の代用とする。白金以外の金属は測定直前に研磨後、0.1 mol・dm-3 HClで前処理を行い、水で十分に洗浄する。電極の研磨・前処理した後すぐ測定する。放置しない。
Cu | 0.01 mol・dm-3 Cu2+ || 0.01 mol・dm-3 Zn2+ | Zn
計算した起電力とダニエル電池を用いて、抵抗尺の目盛りを較正する。
抵抗尺の較正を行うために電位差計(ポテンショメータ)を作成する。
ポッゲンドルフの補償法による電位差測定の回路を組む(ポテンショメーター)。(参考:[新訂物理図解]p.103または[応用物理化学Ⅱ]p.191の図10・2を参照,学生の作った電位測定用抵抗尺開発日記)
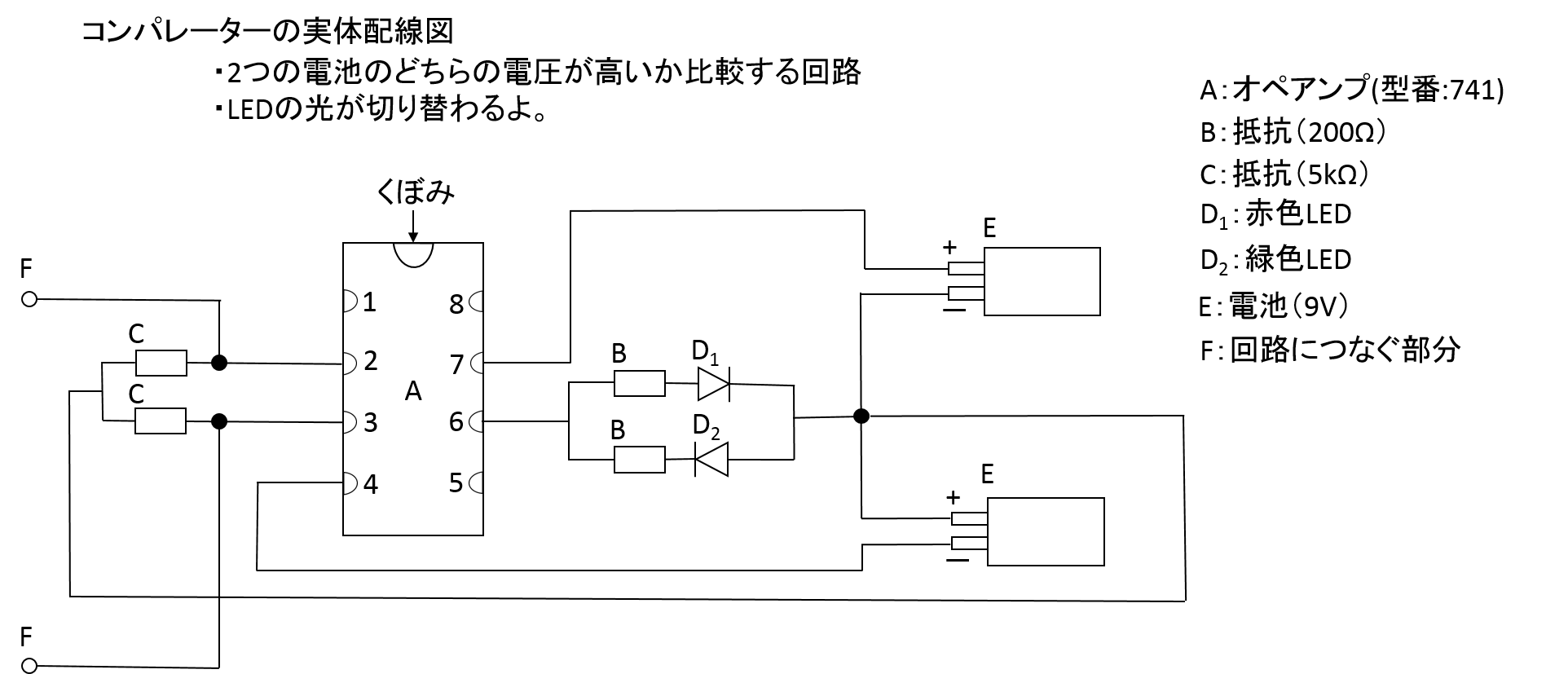
検流計の代わりにコンパレータを作って使う。なお,コンパレータを自作できないとき,TAが準備している検流計をつかってもよいが,検流計は破損しやすいのでTAの指導のもと検流計を使ってください。
(ポテンショメータの標準電池には本来ならウェストン電池を用いるが、ウェストン電池は水銀やカドミウムを使用するため取り扱いに注意を要する。そこで、ここでは標準電池をダニエル電池で代用し、電位や電圧の概念を習得する)。
可変抵抗と電源には抵抗尺とNiCd電池2本を用いる。
標準電池を使ってLEDの色が切り替わる地点(抵抗尺の長さ)l0を見つける。(この地点が検流計の針が触れない点と同じである)その地点が、電流が0になり流れなくなる地点です。
電池には内部抵抗があるので、電池に電流が流れてしまうと電圧降下が起こり正しい起電力を測ることが出来ません。なので、電流が0になる地点を見つける必要があるんです。
標準電池の起電力(ダニエル電池の起電力)は先ほど求めているので、標準電池の起電力E0は抵抗尺の長さがl0の時と決めることが出来る。
もし、起電力の分からない未知の電池があるときに、標準電池の代わりに未知の電池をポテンショメータにつなぐことで、l0との抵抗尺の長さの比から未知の電池の起電力を求めることが出来る。(下図の、電位差計の図の横にある式)
つまり、抵抗尺の長さから電池の起電力を求められる。
テスターを買い忘れた人でも電池の起電力を測ることが出来るんです。

試薬管理日記.卒業論文2017.)
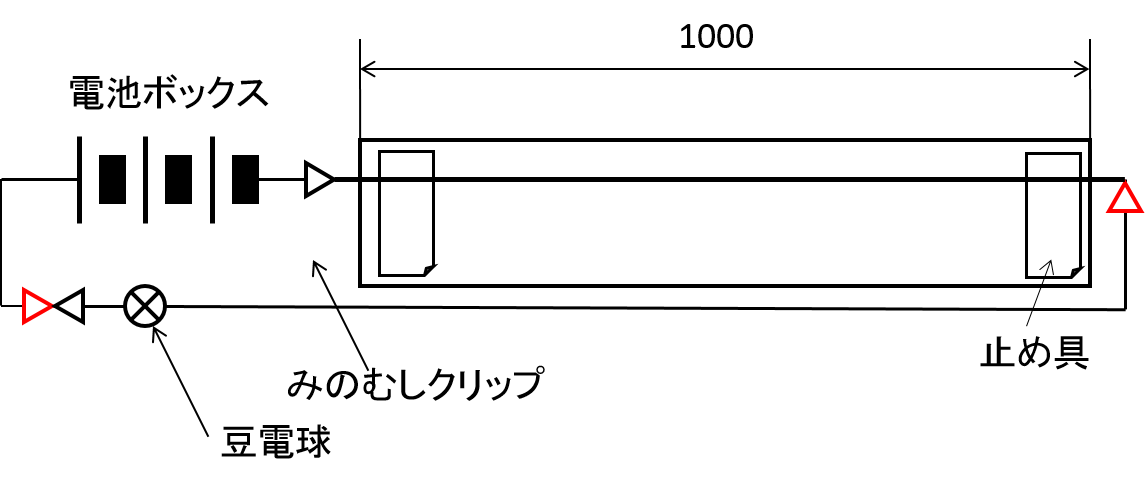
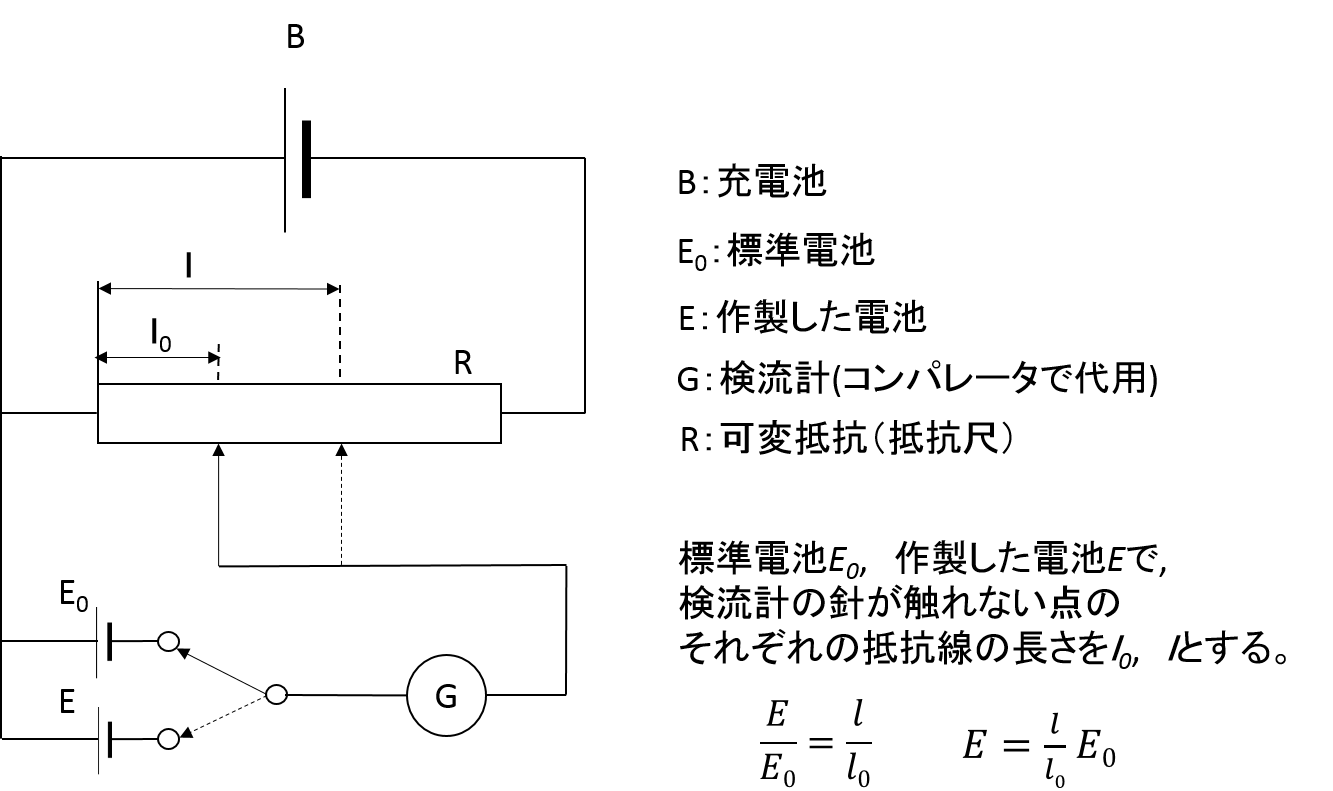
標準電池 の電圧 E0 を抵抗線の 長さ l0 に換算し、被検電池の電圧の抵抗線の 長さ l との比から、被検電池の電圧 E を 測定 します。
米沢高等工業学校本館の 電気・通信科展示室(教室)に 電位差計があります。
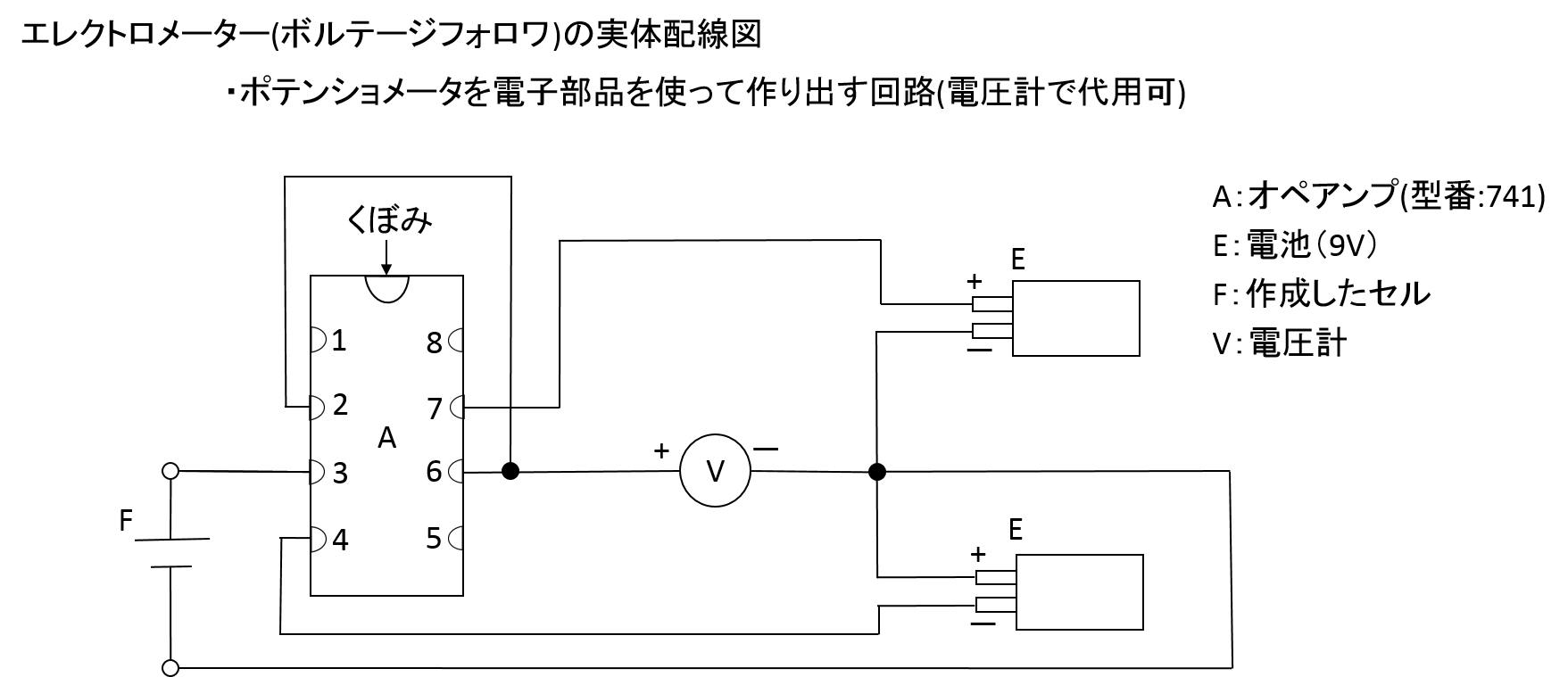
エレクトロメータ(これ以降の実験ではボルテージフォロワとも呼んでいる)は、ポテンショメータを電子部品を使って作り出す回路です。 問1.ダニエル電池と銀塩化銀電極の測定実験について,自分が実際に実験をするときの手順をイメージし、準備するもの(名称と数量)を記述してください。 問2.ダニエル電池と銀塩化銀電極の測定実験について,テキストを読んで,自分が実際に実験をするときの手順をイメージして,その実験手順を記述してください. 問3.ダニエル電池と銀塩化銀電極の測定実験について、実験をイメージして、ダニエル電池の作成手順を記しなさい。 問4.ダニエル電池と銀塩化銀電極の測定実験について、実験をイメージして、銀塩化銀電極の作成手順を記しなさい。 問5.ダニエル電池の電池式を記述してください。 問6.ダニエル電池の起電力とその単極電位を記しなさい。 問1.ダニエル電池の起電力と銀塩化銀電極対する単極電位の測定手順を、自ら実験するイメージで記しなさい。
エレクトロメータを作り、標準電池用に作成したダニエル電池につなぎ、電圧計で電池の起電力を測ってみてください。ポテンショメータで測った時と同じ電圧が計れるはずです。
では、電圧計の部分に10kΩの抵抗を並列につないで見ましょう。すると、電池の起電力はどうなるでしょうか?
電池の起電力が下がりませんでしたか?これは抵抗を並列につないだことで電圧計の内部抵抗が下がって電流が流れるようになってしまうため、電池に電流が流れ電圧降下が起こったんです。
ポテンショメータでは抵抗尺を使って電流が0の地点を探していましたが、エレクトロメータではオペアンプがその地点を探してくれます。つまりエレクトロメータはポテンショメータ(ポッゲンドルフの補償法)の機能をオペアンプで電子的に瞬時に実現する装置と言えるんです。
テスターの電圧計で代用可なのは、この回路がテスターの中に組み込まれているからです。テスターの中には実際こんな回路が入っているんです。
電圧計が電池の起電力を測ることが出来るのは、電池に電流を流さないようにエレクトロメータが制御してくれているんです。
電圧計便利や!!
銀 | 塩化銀電極の標準電極電位を計算する*2,3)。
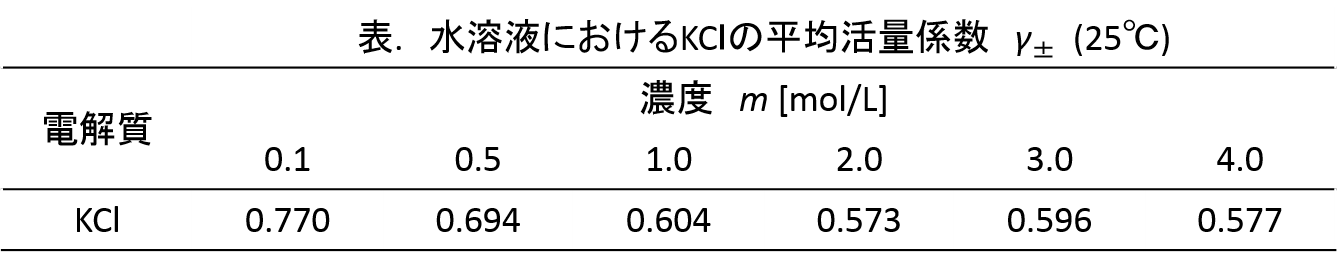
まず、塩化カリウム水溶液の濃度は、実測した室温と塩化カリウムの溶解度から、飽和濃度を求める。(参考:「改訂版 フォトサイセンス化学図録」 p.58 固体・気体の溶解度)
飽和塩化カリウム水溶液の濃度は非常に濃いので活量係数による補正が必要である。
求めたKCl水溶液の飽和濃度と下記の表に対応する平均活量係数の積から活量を求める。(参考:「現代の電気化学」 p.32) あれ・・・濃度が。
実測した室温と求めた活量を用いてネルンストの式から銀 | 塩化銀電極の標準電極電位を求める。
以下のような電池を組み、その起電力を補償法(ポテンショメータ)およびエレクトロメータを用いて測定し、それぞれの単極電位の測定結果からダニエル電池の起電力を計算し、一致することを確かめる。(E0Cu-E0Znになっているかな?)
Cu | 0.01 mol・dm-3 Cu2+ || KCl | AgCl | Ag
Zn | 0.01 mol・dm-3 Zn2+ || KCl | AgCl | Ag

 11-03【課題】ダニエル電池の作成手順と単極電位の測定
11-03【課題】ダニエル電池の作成手順と単極電位の測定
【参考実験動画】
https://edu.yz.yamagata-u.ac.jp/Public/53204/53204.asp#MovieDanielBattery
【参考実験動画】
https://edu.yz.yamagata-u.ac.jp/Public/53204/53204_02_01.asp#MovieAgCl

 11-03-01【課題】ダニエル電池の単極電位の測定
11-03-01【課題】ダニエル電池の単極電位の測定
【参考実験動画】
https://edu.yz.yamagata-u.ac.jp/Public/53204/53204.asp#MovieDanielBattery
電気量が物質量に対応するとしたら、電位は物質の酸化力に対応します。厳密には酸化力は物質と物質の相対的な関係で決まるので、平衡反応に対応することになります。 とは言え Fe3+ と Fe2+ が混ざっていたら、 Fe3+ が多い方が電位が高くなります。 このことを定量的に示したのがネルンストの式です 9 ) 10 ) 。
0.1 mol・dm-3硫酸水溶液を調整します。 硫酸鉄アンモニウム(Ⅱ)と硫酸鉄アンモニウム(Ⅲ)を溶解して、0.025 mol・dm-3鉄イオン(Ⅱ)と0.025mol・dm-3鉄イオン(Ⅲ)の溶液を調整します。 これらの溶液を体積比1:1、1:2、1:5、2:1、5:1で混合した溶液を調整します。 作用極を白金として、銀|塩化銀電極と塩橋でつなぎ、起電力を測定します。 測定した電位は、同時に片対数方眼紙へプロットしてください。 プロットが直線に乗ったらその傾きを求めます。
酸化還元電極は、簡便に溶液の酸化力を測定できるため、水質や殺菌力の測定に応用されます。
堀場水質計総合サイト ORP電極 ORP電極の基礎
設問:ネルンストの式によれば電位は濃度依存性があるが、それはどうしてか?
設問:0.025M鉄イオン(Ⅱ)のみ(鉄イオン(Ⅲ)=0)の場合、あるいはその逆の場合は、ネルンストの式による電位はどうなるか?
設問:鉄イオン(Ⅱ)と鉄イオン(Ⅲ)の組み合わせとしてフェリシアン化カリウム/フェロシアン化カリウムの系について行った場合はどうか?
起電力を測定することで、難溶塩の溶解度を測ることができます。 11 )
以下の電池を組み、補償法(ポテンショメータ)およびボルテージフォロワによって起電力を測定して、水酸化銅の溶解度積を求める。
銅は測定直前に研磨し、水で素早く洗浄する。この電池は特に分極しやすいので、塩橋で電解液をつないだら、できるだけ早く起電力を測定する。放置しない。再び測定したい場合には、銅電極を取り出して再度清浄な面を出す。
Cu | Cu2+ | OH- | Cu(OH)2 | Cu
(Cu | 0.01 mol・dm-3 CuSO4 || KCl || 0.05 mol・dm-3 KOH | Cu(OH)2 | Cu)
また、以下の電池を組み、起電力を測定して銅アンミン錯体の安定度定数を求める。
0.1 mol・dm-3アンモニア水50mLに、0.01 mol・dm-3硫酸銅を2.0mL加えて電解液とし、補償法(ポテンショメータ)およびボルテージフォロアによって起電力を測定する。
全てが反応して銅アンミン錯体になるものとして濃度を計算する。銅イオンとアンモニアの濃度から酸化還元電位を求め、安定度定数を計算する。
Cu | Cu2+,NH3 || Cu2+ | Cu
(Cu | 0.1 mol・dm-3 NH3,0.01 mol・dm-3 CuSO4 || KCl || 0.01 mol・dm-3 CuSO4 | Cu)
計算例

?設問:電気化学的に溶解度積や安定度定数を測定するメリットは何か?

 11-01 【課題/自学】コイン電池の起電力測定
11-01 【課題/自学】コイン電池の起電力測定
問1.日常品を使って、4種類以上の硬貨を使ってコイン電池を作成し、コイン間の電圧を測定して、すべての組み合わせの電圧を記しなさい。
参考実験: https://edu.yz.yamagata-u.ac.jp/Public/53204/53204_02_01_01.asp
問2.前課題の電圧の差を用いて、硬貨の電位を求め、ノートに数直線プロットしてください。 プロットした数直線の写真を撮り、JPEG形式の写真を提出してください。

 11-01-01 【課題/自学】コイン電池の起電力測定
11-01-01 【課題/自学】コイン電池の起電力測定
問1.自作したコイン電池の写真をJPEG形式でアップロードしてください。
問2.自作コイン電池を測定している様子をアップロードしてください。
両面テープを実験台に貼ってセルを固定します.あれ,あれあれ,固定できないなぁ.
気を取り直して,もういっちょ.両面テープを貼って,補強補強.さぁー今度はどうだ?
今度は,大きくして折り曲げて暑い両面テープを貼ってやるー!よっしゃー,固定できた.ごみを捨てて5S, 5S!
抵抗尺の組み立てと動作確認をしましょう.
さー,0.1Mの塩酸水溶液の電解液を入れて,開回路電圧(OCV)を測定しよう. OCVと同じ電圧にする抵抗尺の長さを求めて,電流計にモードにテスターを切り替えて,徐々に電圧を上げて,電解を開始する. 泡がぷくぷく,電気が流れた証拠だね.さらに,銀電極の色もみるみる変わっていくぞ,観察記録をつけて,そのまま,時間を15分ほど進める.
時間もたって,銀電極の色も黒っぽくなってきた.ぼちぼち電解終了.
さー,2本目の銀|塩化銀電極を同じ操作で作ろう.
2本できたら,電位差を測って,その電位が5mV以下なら完成.はーい.1.5mVだね.よくできました,仁科君, 💮!
