 🏠
🏠
 🏠
🏠
化学実験Ⅰのエネルギー化学分野は、2024年度より 化学実験Ⅱとして開講されます。
電解液の種類と電極の種類を変えて、電解槽を組み立て、電流と槽電圧(浴電圧)の関係を調べます。同じ電解液でも電流が流れ始める槽電圧(分解電圧)が違うことを確かめ、理論分解電圧とのずれである過電圧について理解を深めます。電流と電圧の関係を調べるボルタンメトリーの手法についても学びます。
先生:「いつものように実験は安全第一、実験台の上を整理整頓して服装を整え、手を洗ったら実験開始だ」
学生:「はいっ」
先生:「今日は白金線を電極に使おう。白金は高価な材料だから針金みたいに折り曲げたりして遊んだらだめだよ」
学生:「高いから、こんなちょっぴりしかないのか。それにしてもぴかぴかしてきれいですね~」
先生:「貴金属だからね、化学的に安定ってわけ。電解液には硫酸を使おう。ではセルを組み立ててください。」
先生:「セルがちゃんと組み立てられたかどうか電圧計で電圧を測定してみよう、ほぼ0だね?」
学生:「はいっ」
先生:「じゃあ、このセルに電圧を印加してみよう。まずは乾電池ひとつを直接つなぐ」
学生:「プラスからみのむしコードをつないで・・・マイナスも・・・できました!」
先生:「電極の様子は?」
学生:「とくに変化無いような。」
先生:「電圧も測っておこう」
学生:「だいたい1.6Vぐらいかな」
先生:「じゃあ、乾電池をふたつ直列につないで電圧を高くしてみよう、おっと、つなぐ前に電極の様子をちゃんと見て!」
学生:「はーい・・・おぉっ!つないだ瞬間に電極から泡がしゅわーっと」
先生:「はい、電圧は?」
学生:「だいたい3Vぐらいかな」
先生:「大雑把な目安として硫酸を支持電解質としたときの水の分解電圧は乾電池1個より大きく、乾電池2コ未満てことがわかったね」
先生:「大雑把な電流も読み取れる?」
学生:「えっと・・・」
先生:「今、1秒間に発生しているガスの量が22.4リットルもあると思う?」
学生:「いいえ?」
先生:「じゃあ1秒間にどれくらい?」
学生:「mLぐらいかなあ」
先生:「その体積をモルに換算してファラデー定数かければ大雑把な電流が見積もれるよね?」
学生:「なるほど!」
学生:「先生、もう少し電圧の精度を上げたいです!!!」
先生:「では抵抗尺を使いましょう」
学生:「どうやって使うんですか?」
先生:「では抵抗尺の両端に電源をつないで、抵抗尺を電圧減衰器、アッテネータとして使うんだよ」
学生:「ほうほう」
先生:「抵抗尺に張ってあるニクロム線の電気抵抗は長さに比例するから、みの虫コードをつなげたところまでの長さに相当する電圧が得られるわけだ」
学生:「なるほど!」
V = V0 * l / l0
学生:「泡が発生する電圧は___ぐらいですかねえ・・・」
先生:「電解槽による電圧降下があるから、ニクロム線の長さだけでなく直接、電解槽の電圧を電圧計で測定しておこう」
学生:「ああ、銅クーロメーターでも測定した槽電圧ですね!ということは電流計で通電電流も測ったほうがいいですね」
先生:「そうやって、電圧と電流の関係をプロットしたグラフを電流電圧曲線といって、電気化学ではもっとも基本的なデータだね!」
先生:「ところでなぜ分解電圧を測定したか覚えてる?」
学生:「えっと・・・ああ、そうだ。分解電圧の電圧をできるだけ小さくするため!」
先生:「そうそう、水の理論分解電圧は?」
学生:「0123・・・1.23V」
先生:「今回の実験結果は?」
学生:「___V、あれあれ理論分解電圧より大きいよ」
先生:「うん、実際の分解電圧と理論分解電圧との差を
過電圧
っていうんだ」
学生:「ということは
過電圧
が小さい方が省エネなんだね!」
先生:「その通り!」
*
過電圧が大きい場合、実際の電圧よりも大きな電圧をかけなければ反応が起きません。
つまり、より多くの電力を消費してしまうのです。
これでは省エネになりません。(エネルギー効率が低いとも表現される)
過電圧を小さくしてより省エネ(エネルギー効率を高く)するには、電極面積・反応面積を大きくする、電極間の距離を近くするなどの方法があります。
しかし、うっかり電極の距離を近くしすぎると反応による析出物が成長し、電極同士が接触して短絡を起こしてしまったり、ガス発生による空気の絶縁が起こってしまうので注意が必要です。
実験では、電極の様子はしっかり観察しましょう。
工場では、このエネルギー効率を高くするために日々工夫がなされています。
電気代安くしたい!!みんな一緒やね!!。
学生:「あれれ・・みの虫コードをスライドさせて電圧を変化させると電流が変化するよ?」
先生:「いいところに気づいたね!それは電極の表面に電気二重層が形成されれ充電電流も観察されるからだよ、
ちなみに電位掃引速度を一定にして測定するテクニックをLSVと言います」
学生:「なるほど」
先生:「では、電解液の種類を変えて分解電圧がどう変化するか調べてみようか。」
学生:「はい」
先生:「今度はアノードとカソードと電極の種類が違うからプラスとマイナスの向きに注意して回路を接続してね!」
アノードとカソードに白金を用いて電解液に0.1 mol・dm-3 H2SO4を用いて電池を組み、抵抗尺を使って電圧を変えて電流電圧曲線を測定し、分解電圧を求める。
方眼紙へのプロットは測定と同時に行うこと。
理論分解電圧と実測値の差から過電圧を求める。
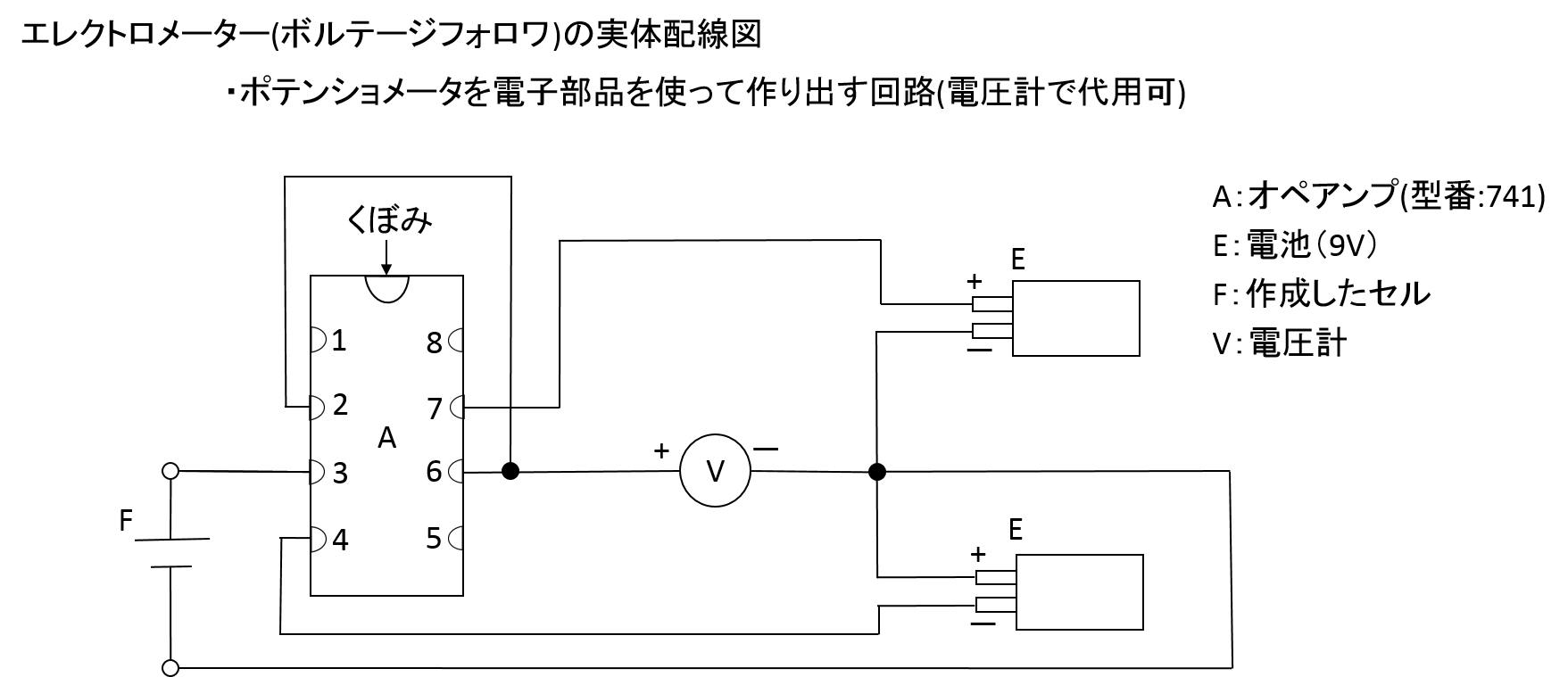
電流の測定にはカレントフォロワ(電流計で代用可)を、電圧の測定にボルテージフォロワ(電圧計で代用可)を用いることを推奨する。
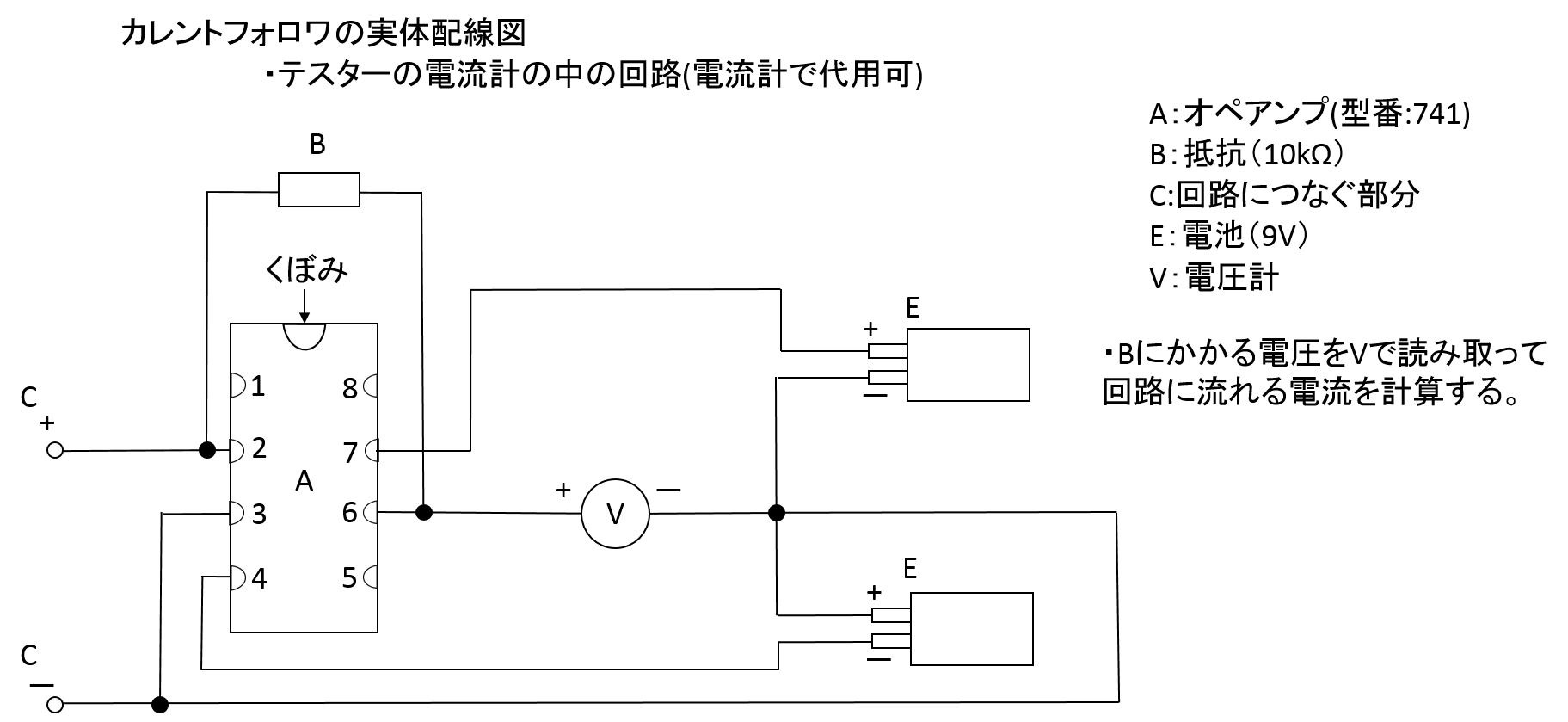
カレントフォロワは、電流電圧変換器とも呼ばれます。一種の電流センサーです。
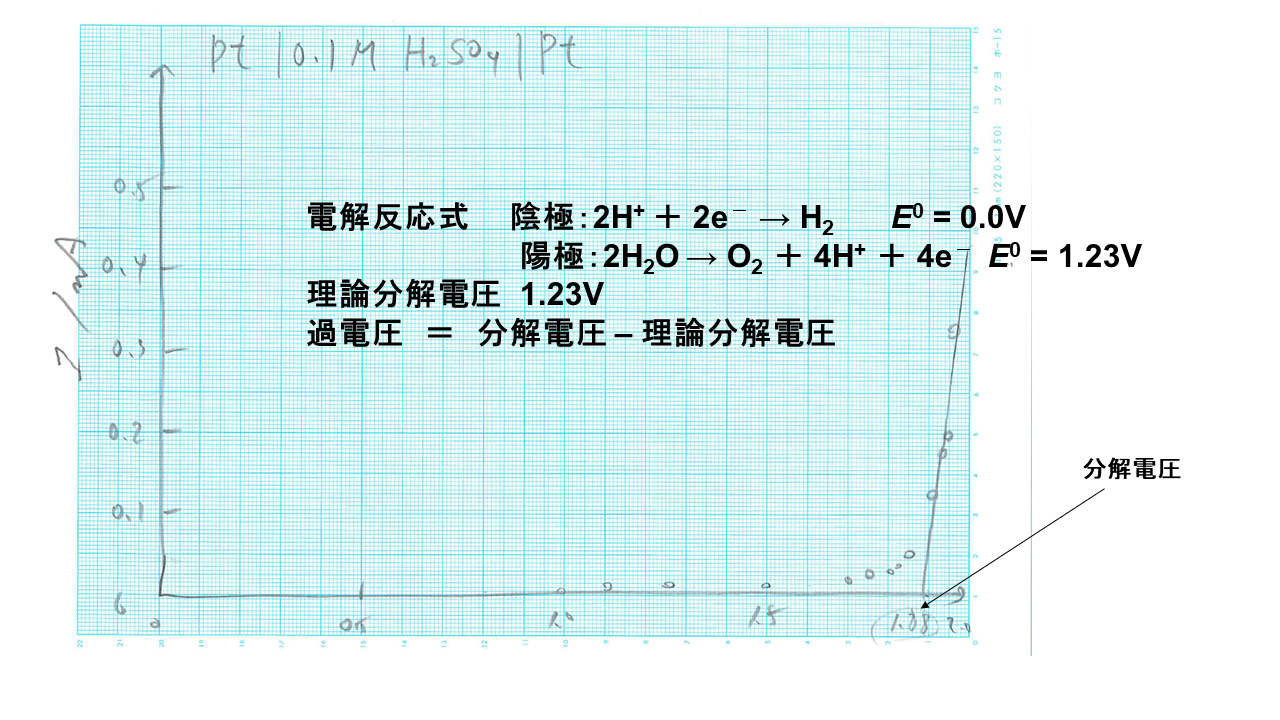
水の 理論分解電圧は、298.25Kで 1.229-0=1.229Vです。 硫酸が電解質の場合、図から読み取った、分解電圧は1.88Vです。 従って 過電圧 は、1.88-1.229=0.651Vです。
では、pHを変えた場合に、白金電極の水素過電圧や酸素過電圧はどう変わるでしょうか?
同様に電解液に0.1 mol・dm-3 NaOHを用いて電池を組み、抵抗尺を使って電圧を変えて電流電圧曲線を測定し、槽電圧から実測の分解電圧を求めます。 理論分解電圧と実測の分解電圧の差から過電圧を求めます。 pHが変わっても過電圧があまり変わらないことを確認します。
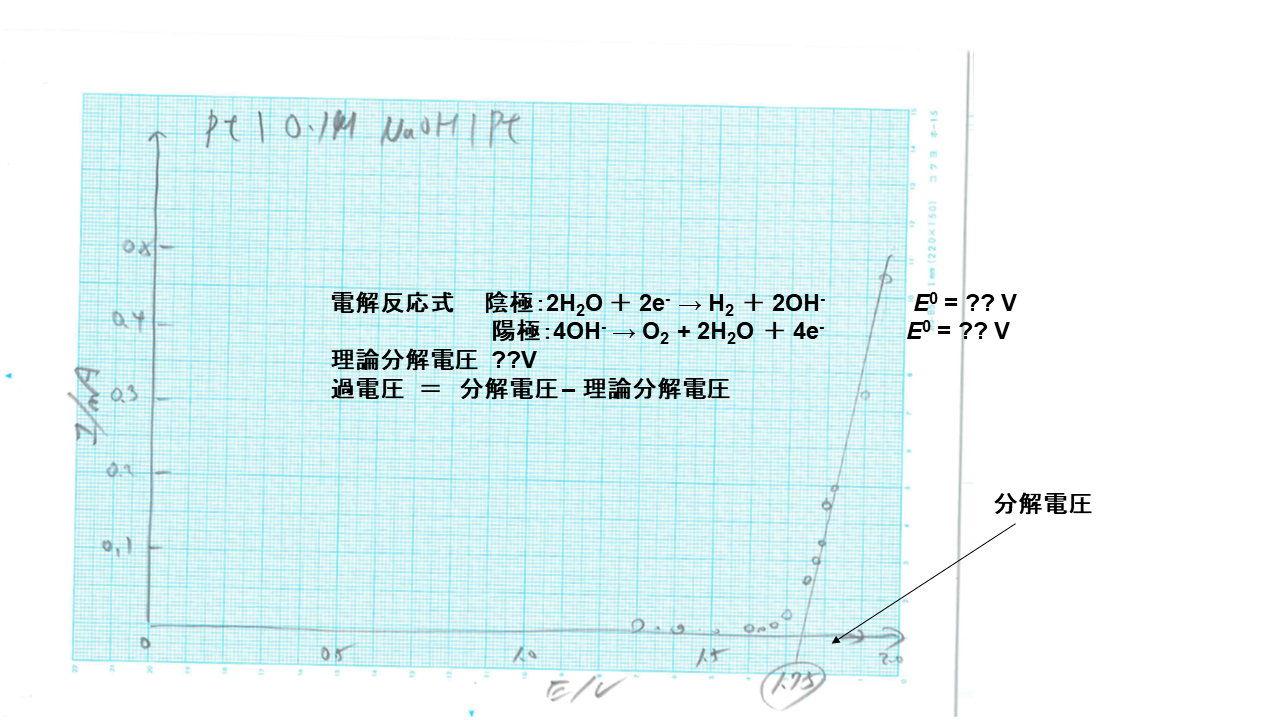
アノード、カソードに 白金を使って、水酸化ナトリウム水溶液を分極した電流‐電圧曲線です。 化学実験Ⅱの予備実験では、分解電圧は1.75Vでした。 そこから水の理論分解電圧を差し引いた過電圧は0.49Vでした。
水電解です 2 ) 。 アノードの析出物質は、酸素で、 カソードの析出物質は、水素です。 ナトリウムイオンは、電気を流す支持電解質で、電気分解には関与しません。
水の 理論分解電圧は、表より298.25Kで0.401-(-0.8285)=1.2295Vです。 pHが変わっても、水の理論分解電圧は変わりません。 水酸化ナトリウムが電解質の場合、図から読み取った、分解電圧は1.73Vです。 従って 過電圧 は、1.73-1.23=0.5Vです。
同様に電解液に0.1 mol・dm-3 HClを用いて電池を組み、抵抗尺を使って電圧を変えて電流電圧曲線を測定し、分解電圧を求める。
理論分解電圧と実測値の差から過電圧を求める。
析出物質が酸素から塩素変わると過電圧が小さくなることを確認する。

アノード、カソードに 白金を使って、希塩酸を分極した電流‐電圧曲線です。 化学実験Ⅱの予備実験では、分解電圧は1.52Vでした。 そこから水の理論分解電圧を差し引いた過電圧は0.29Vでした。
アノードの析出物質は、塩素で、 カソードの析出物質は、水素です。
ほぼ同じpHでの、 希硫酸の分解電圧と比べると、 析出物質が、酸素から塩素になることで、過電圧が小さくなることがわかります。 一般に、塩素過電圧は、酸素過電圧より小さいことが知られています。
塩酸の 理論分解電圧は、表より298.25Kで1.3583-0=1.3583Vです。 pHが変わっても、水の理論分解電圧は変わりません。 塩酸の場合、図から読み取った、分解電圧は1.52Vです。 従って 過電圧 は、1.52-1.3583=0.1617Vです。
硫酸水溶液、水酸化ナトリウム水溶液、塩酸で、カソード反応は同じです。 したがって、過電圧の違いは、アノード反応によることになります。 つまり、塩素過電圧の方が、酸素過電圧より小さいと結論づけることができます。
アノードに白金、カソードに銅、亜鉛、黒鉛を用い、0.1 mol・dm-3 H2SO4の電池を組み、抵抗尺を使って電圧を変えて電流電圧曲線を測定し、分解電圧を求める。
理論分解電圧と実測値の差から過電圧を求める。
白金以外の金属は測定直前に研磨後、0.1 mol・dm-3 HClで前処理を行い、水で十分に洗浄する。
同様にカソードに白金、アノードに鉄、ニッケル、黒鉛を用いた場合について、0.1 mol・dm-3 NaOHの分解電圧を測定し、過電圧を求める。
金属電極の種類を変えると水素過電圧が変わることを確認する。
Pt | H2SO4 | Cu
Pt | H2SO4 | Zn
Pt | H2SO4 | C
同様にカソードに白金、アノードに鉄、ニッケル、黒鉛を用いた場合について、0.1 mol・dm-3 NaOHの分解電圧を測定し、過電圧を求める。 金属電極の種類を変えると酸素過電圧が変わることを確認する。
Fe | NaOH | Pt
?設問:どの電位から測定を開始すれば良いか? またそれはどうしてか? 分解電圧を正確に求めるにはどうしたら良いか? 分解電圧と過電圧はどのような関係にあるか?
?設問:電極表面における気泡発生の仕方と電流はどのような関係が見られたか? またそれはどうしてか? 同じ電位でも電流が変化する場合があるのはなぜか? またそのような場合、正確な電流値を得るにはどのように測定すれば良いか?
?設問:電極表面に気泡が発生していないのに,電位を変化させると,変化させた直後と時間が経過したときで電流値が違うことがある.どのときの電流を測定すれば良いか?
?設問:工業電解における過電圧がエネルギー効率に与える影響について述べよ。
鉄のボルタンメトリを測定する。
ファンクションジェネレータと
ポテンショスタットを作成して測定することを推奨する。
ファンクションジェネレータとポテンショスタットをつなぐ場合はファンクションジェネレータのDの部分にポテンショスタットのFの部分をつなぐ。
作用極、対極、参照電極の三つの極を使って測定を行う場合、参照電極と作用極の電位を測りたいので、参照電極には電流を流したくない。そのため、ボルテージフォロワ(*電池の起電力の実験で先に登場している)を組み込んで電位を測定している。

?設問:鉄の不働態化の挙動をガルバノスタットで測定した場合、どのような結果が得られるか?
サイクリックボルタンメトリー
 11-11 課題】分解電圧の測定
11-11 課題】分解電圧の測定
問1.析出物質による過電圧の違いの実験について,自分が実際に実験をするときの手順をイメージし、準備するもの(名称と数量)を記述してください。
析出物質による過電圧の違いの実験について、実験をイメージして、セルの組み立てやメメートルブリッジ配線や操作を組み立てを含めた実験手順書を記しなさい。
【参考実験動画】
https://edu.yz.yamagata-u.ac.jp/Public/53204/53204.asp#DecompositionVoltage
【関連URL】
