 🏠
🏠
 🏠
🏠
| 電極反応 |
電位
/ V |
/ mV/K |
/ mV/K |
|
|---|---|---|---|---|
| 2H2O + 2e- → 2OH- + H2 | -0.8285 | 0.037 | -0.834 | アルカリ性 |
| H+ + 2e- → H2 | 0.000 | 0.871 | 0.000 | 酸性 |
| O2 + 2H2O + 4e- ← 4OH- | 0.401 | -0.809 | -1.680 | アルカリ性 |
| O2 + 4H+ + 4 e- ← 2H2O | 1.229 | 0.025 | -0.846 | 酸性 |
pH0(酸性)では、1.229 (酸素)-0.000 (水素)≒1.23、pH14(アルカリ性)では、0.401 (酸素)-(-0.8285 (水素))≒1.23となって どちらも同じ1.23Vです。 電位-pH図でみると、 水の電位窓がpHによらず1.23Vです。 この1.23Vが、 水電解の電解槽における水の 理論分解電圧 であり、酸素水素燃料電池の 電池の起電力です。
「酸素水素燃料電池の 起電力 =水の 理論分解電圧 」です。
水を水素と酸素に熱分解しようとしたら、2500度もの高温が必要です。 電気を使えば、室温で乾電池をふたつ直列につなぐだけで、水素と酸素に 電気分解できます。
25℃、1atmでの 平衡電位の差を理論分解電圧と言い、1.23Vです 1 ) 。 理論分解電圧は、自由エネルギーより計算され、理論稼働電圧は、 エンタルピーから計算されます 2 ) 。
速度論について議論します。 セルに電流を流すということは反応を進行させるということでです。 電流をファラデー定数と反応に関与する電子の数で割ったら反応速度です。
かつては水素は水を電気分解して得る水電解が重要なプロセスであった 6 ) 。
水電解ではなくトルエン電解?
電流計を電池に直接つないではいけません! まずは電流を測定してみましょう。 乾電池の電圧を開回路電圧で測定します。 次に電流を流して測定します。 流した電流はいくらでしたか? 電圧降下から内部抵抗を求めてみましょう。
分解電圧を調べるときは、電圧を掃引して、電流を測定します。 これを LSV (リニアスイープボルタンメトリー)ということもあります。 電流電圧曲線から、溶液抵抗の傾きを外挿して、分解電圧を求めます。 理論分解電圧から分解電圧を引いて、 過電圧を求めます。 過電圧を電流密度の対数の関係をターフェルプロットと言います。
電池では、電流を掃引して、電圧を測定します。 求めた電流電圧曲線は、電池の放電の 内部抵抗 を求めるのに使われます。
平衡電位の差の理論分解電圧を超えたからといってすぐには反応ははじまりません。 実際に反応が始まる電圧を分解電圧といいます。
平衡電位から電位をずらす(分極)すると、活性化過電圧のみの場合は、ある電位から指数関数的に電流が増加します。電流は反応速度を表します。 実際には溶液抵抗が存在するので、電流はあるところから直線的に増加するようになります。 分解電圧は、その直線を外挿して求めます。
ポテンショスタットの参照電極につなぐ端子を対極につなぎ、 二極式セルとして、分極曲線を測定すると、分解電圧を求めることができます。
理論分解電圧と分解電圧の差を過電圧といいます。 過電圧には抵抗過電圧、濃度過電圧、活性化過電圧があります。
工業電解 の場合に特に重要な析出物質、水素、酸素、塩素にはそれぞれ水素過電圧、酸素過電圧、塩素過電圧 と呼ばれています。 電極の金属の種類によって過電圧が異なります。電解の場合には過電圧の小さな金属が選ばれます。 逆に電池の負極の場合には自己放電が小さく起電力が大きくなるように過電圧の大きな金属が選ばれます。
| 過電圧 | 場所 | 内容 | 特徴 |
|---|---|---|---|
| 活性化過電圧・反応過電圧 | 界面 |
深度に依存する、可逆な 内部抵抗、 水素過電圧、 酸素過電圧、など。 特別な条件下では、 ターフェルの式で知られます。 界面 の交換電流密度J0が大きいほど、活性化過電圧は小さい。 | 非線形・定常 |
| 拡散過電圧・濃度過電圧 | 界面 |
界面 の濃度が時間とともに変化するので、濃度過電圧も時間とともに変化する。 界面 の濃度が大きいほど、濃度過電圧は小さい。 物質輸送がまにあわず、界面の濃度が低下すると濃度過電圧は大きくなる。 f(t)の中身は、誤差関数や、拡散係数などが入った込み入った関数です。 |
非線形・非定常 |
| 抵抗過電圧 | バルク |
溶液抵抗(導電率と セル定数に依存)、接触抵抗、 充電式電池では、サイクルごとに増える不可逆な 内部抵抗 |
線形・定常 |
| 界面 | 接触抵抗など。 | 線形・定常 |
過電圧が線形なら、 電池の内部抵抗は、過電圧を電流で割ったものです。
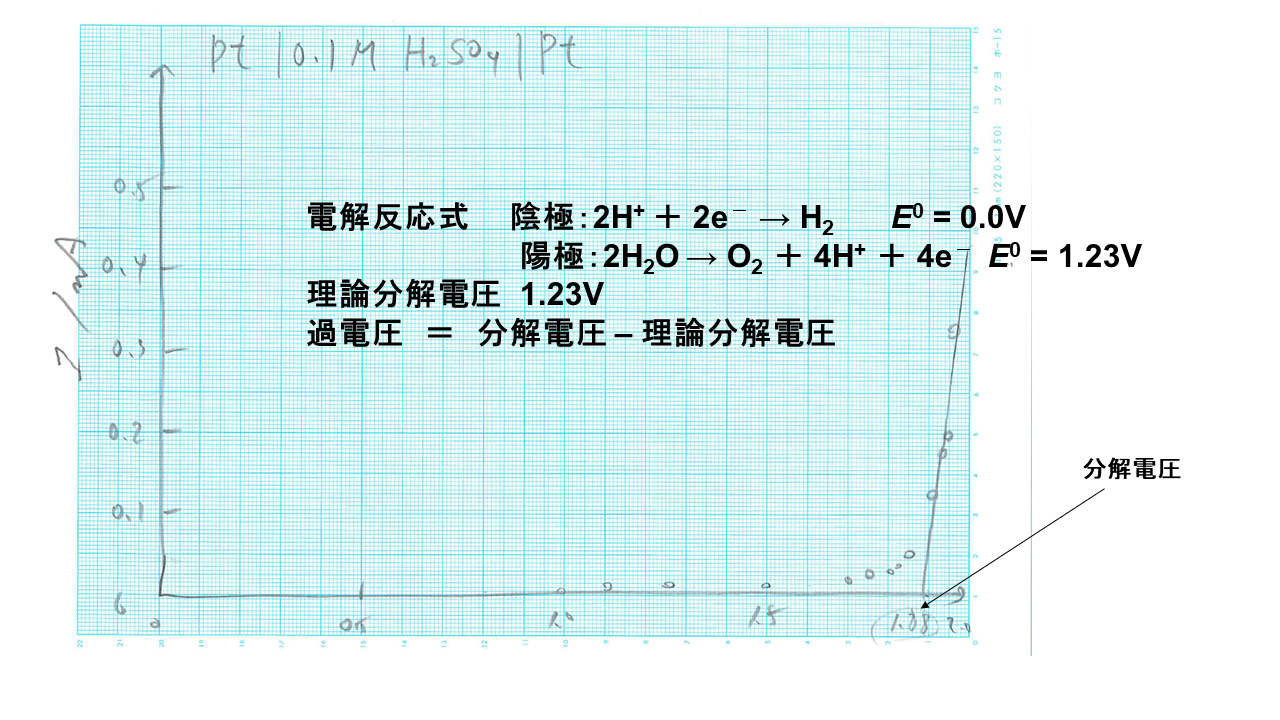
水の 理論分解電圧は、298.25Kで 1.229-0=1.229Vです。 硫酸が電解質の場合、図から読み取った、分解電圧は1.88Vです。 従って 過電圧 は、1.88-1.229=0.651Vです。
201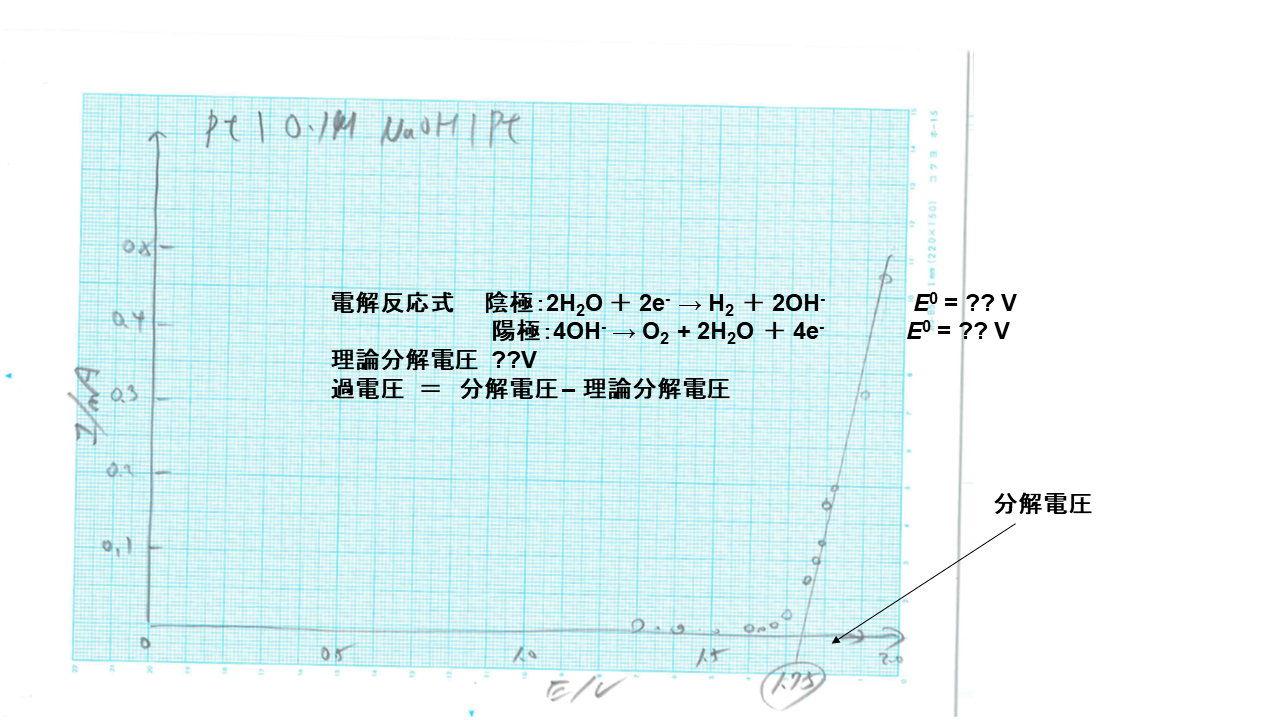
アノード、カソードに 白金を使って、水酸化ナトリウム水溶液を分極した電流‐電圧曲線です。 化学実験Ⅱの予備実験では、分解電圧は1.75Vでした。 そこから水の理論分解電圧を差し引いた過電圧は0.49Vでした。
水電解です 8 ) 。 アノードの析出物質は、酸素で、 カソードの析出物質は、水素です。 ナトリウムイオンは、電気を流す支持電解質で、電気分解には関与しません。

アノード、カソードに 白金を使って、希塩酸を分極した電流‐電圧曲線です。 化学実験Ⅱの予備実験では、分解電圧は1.52Vでした。 理論分解電圧は、1.3583Vです。 よって分解電圧から理論分解電圧 を差し引いた過電圧は0.1617Vでした。
アノードの析出物質は、塩素で、 カソードの析出物質は、水素です。
ほぼ同じpHでの、 希硫酸の分解電圧と比べると、 析出物質が、酸素から塩素になることで、過電圧が小さくなることがわかります。 一般に、塩素過電圧は、酸素過電圧より小さいことが知られています。
203| 電池式 | Pt | HCl | Pt |
| アノード 反応 | Cl2 + 2e- ← 2Cl- Eº = 1.3583V |
| カソード 反応 | H+ + 2e- → H2 Eº = 0V |
| 理論分解電圧 | Ed = Eºa-Eºc = 1.3583V |
塩酸の 理論分解電圧は、表より298.25Kで1.3583-0=1.3583Vです。 pHが変わっても、水の理論分解電圧は変わりません。 塩酸の場合、 図から読み取った、分解電圧は1.52Vです。 従って 過電圧 は、1.52-1.3583=0.1617Vです。
| 金属 | 説明 |
|---|---|
| ↑水素過電圧小 | |
| Pt | 金属と電解液が オーミックコンタクトになるため、水素過電圧が小さい。 作用極として使われます。 |
| Pd | |
| Ru | |
| Rh | |
| Au | |
| Fe | |
| Co | |
| Ag | |
| Ni | |
| Cu | |
| Cd | |
| Sn | |
| Pb | |
| Zn | |
| Hg | 水素過電圧が大きいため、かつては乾電池の自己放電を防ぐため負極の亜鉛に添加されていました |
| ↓水素過電圧大 |
乾電池の負極(アノード)には、水素過電圧の大きい亜鉛を使います。 イオン交換膜法のソーダ電解では、カソードにニッケルを使います。
| 金属 | 説明 |
|---|---|
| ↑酸素過電圧小 | |
| Ni | |
| Fe | |
| Pb | |
| Ag | |
| Cd | |
| Pt | 金属と電解液が オーミックコンタクトになるため、水素過電圧が小さい。 作用極として使われます。 |
| Au | |
| ↓酸素過電圧大 |
チタンは不溶性ではあるけれど、表面に酸化皮膜をつくるためアノードに使うと、酸素過電圧が大きくなります。 そこで酸化ルテニウム(触媒)をコーティングした寸法安定化電極(DSE)が使われます。 イオン交換膜法のソーダ電解では、かつてアノードに黒鉛が使われていましたが、DSEに置き換わりました。
野村正勝・鈴鹿輝男,
最新工業化学―持続的社会に向けて―
, 講談社サイエンティフィク, ,
(2004).
電解の化学
山下正通、小沢昭弥, 現代の電気化学, 丸善 , 目次 (2012).
電解の条件を設定するのに、抵抗を使って任意の電圧を電解槽に印加する方法を調べ、説明しなさい。またそのときに流れる電流を測定する方法についても調べて、説明しなさい。
分解電圧と理論分解電圧から過電圧を求める方法を調べ、説明しなさい。
電圧効率と電流効率から電力効率が求まります。
電流密度と過電圧には一定の関係があります。 実験的に求めた式をターフェルの式といいます。 ターフェルプロットをしてみましょう。 電位を平衡電位からずらすことを分極といいます。 一定の速度で分極して得られるグラフをボルタモグラムといいます。
keisan:ターフェルの式過電圧が大きいと、電解の効率が下がり、 電池の内部抵抗が大きくなります。 反面、腐食や、電池の自己放電は抑えられます。 水溶液系電池の負極活物質には、水素過電圧の大きい、亜鉛、カドミウム、水銀などが使われていました。 このうち、水銀やカドミウムは、環境汚染につながるということで、現在では水銀フリーの亜鉛が使われています。 しかし、自己放電を抑えるために、毒性の高い金属が使われており、いまでも使い終わった乾電池は有害ごみです。
電流が大きくなると溶液抵抗が支配的になり下記のようになります。 溶液抵抗から外挿して交点が分解電圧ということになります。 分解電圧から理論分解電圧を差し引けば反応過電圧が求まります。
電解の電圧効率を向上させる方法について調べ、説明しなさい。
| プロセス |
アルミ ニウム 溶融塩電解 |
食塩電解 |
銅 電解精錬 |
亜鉛 電解採取 |
|---|---|---|---|---|
| 🏞 原料 | 食塩(岩塩) | |||
| 製品 | 亜鉛 | |||
| 理論電気量 /kAh/t | 2980 | 670 | 844 | 820 |
| 理論分解電圧 /V | 4.17 | 2.2 | 0.1×10-3 | 2.0 |
| アノード 電流密度/A/m2 | ||||
| 単槽 電圧/V | ||||
| 電気量原単位 /kAh/t | 3350 | 910 | ||
| 電解電力 ( 電力原単位 ) /kWh/t | 13400 | 2200 | 284 | 3000 |
| 電流効率 | ||||
| 電圧効率 | ||||
| エネルギー効率 9 ) |
理論分解電圧とは、アノードとカソードの平衡電位の差であって、槽電圧(浴電圧)をこれ以下に切り下げることはできません 。
10 )
電解槽は、電気エネルギーを使った 反応器です。アノード、カソードの電極を備え、それぞれで酸化反応、還元反応を進行させます。
この「アルミニウム電解槽」は、昭和電工(株)大町工場に設置され 11 ) 、 昭和9年(1934年)1月11日、国産初の「アルミニウム」を生産したわが国最初の 「電解槽」 を、 当時のままに実物大に再生したものです。 大町市は、この 「電解槽」 から生産された国産アルミニウムにより、「アルミニウム発祥の地」の栄誉を、永遠に記録されることとなりました。
| 電解槽 | Ti| RuO(DSA) | NaCl aq | イオン交換膜 | NaOH aq | Ni |
| アノード 反応 | Cl2 + 2e- ← 2Cl- Eº = 1.3583V |
| カソード 反応 | 2H2O + 2e- → 2OH- + H2 Eº = -0.8285V |
| 全反応 | 2NaCl + 2H2O → 2NaOH + Cl2 +H2 |
| 理論分解電圧 | e.m.f. = 2.1868V |
食塩水を電解すると、塩素ガス、水酸化ナトリウム(苛性ソーダ)、それに 水素が得られます。 これを、工業的に食塩電解(chlor-alkali electrolysis)ソーダ電解、あるいは塩素・アルカリ電解と呼ばれます。 アノードにはチタンが使われますが、 塩素過電圧を小さくするために、触媒として酸化ルテニウムを被覆したものを使います。 19 ) 。 20 )
👨🏫 東北東ソー化学@山形県酒田市
pH試験紙に食塩水を染み込ませて電気を流すとの電気分解が起きます。 いわゆる 食塩電解です。 アノード では塩素が発生し、 カソード では水素が発生します。 カソードでの水素の発生に伴い、水素イオンが枯渇し、カソード付近はアルカリ性になります。 水素の発生電位は、 pHに依存するので、徐々に下がります。 電極近傍と沖合(バルク)では、水酸化物イオンの濃度勾配が生じて、拡散による物質移動が起こります。
次回の 電気化学は 工業製品への応用1―アルマイト・エッチング―を勉強しましょう。
エネルギー変換化学特論: 電池の内部抵抗と過電圧
野村正勝・鈴鹿輝男
最新工業化学―持続的社会に向けて―
講談社サイエンティフィク
松林光男、渡辺弘,
イラスト図解 工場のしくみ
,日本実業出版社
山下正通、小沢昭弥, 現代の電気化学,
丸善
,
目次
, (2012).
銅めっき 米沢高等工業学校本館から 銀電量計を探してみよう。
アノードもカソードも銅だったら、理論分解電圧は何Vになるか?