化学工学とリチウム電池~分散・スラリーの作成と塗布乾燥~. 山形大学, 電気化学特論 講義ノート, 2018. https://edu.yz.yamagata-u.ac.jp/developer/Asp/Youzan/@Lecture.asp?nLectureID=4045 , (参照 ).
 🏠
🏠
 🏠
🏠
エネルギーと ネットがつながりつつあります。 電池が物質とエネルギーを橋渡しするものだとすれば、 ネットは情報を橋渡しするものです。
情報網と電力網をあわせたスマートグリッド構想が進んでいます。限りある資源を賢く使う時代です。
LCCM住宅(ライフ・サイクル・カーボン・マイナス住宅)とは、ZEH(ネット・ゼロ・エネルギー・ハウス)よりさらに省CO2化を進めた先導的な脱炭素化住宅で、建設時、運用時、廃棄時において出来るだけ省CO2に取り組み、さらに太陽光発電などを利用した再生可能エネルギーの創出により、住宅建設時のCO2排出量も含めライフサイクルを通じてのCO2の収支をマイナスにする住宅です。 ※
V2Hとは、 電気自動車の電池を、 住宅の電池(ESS)にリユース することです。 電気自動車の 電池容量は、 40kWh程度とすれば、住宅の電池10kWhの4世帯分に相当します。
しかし安全に リユース するには、バッテリーのインスペクションが欠かせません。
リモコン、 マイクロモビリティ 超小型モビリティの導入・運行に当たって
| 状態 | 備蓄 | 輸送 | ||
|---|---|---|---|---|
| 物質 | 固体 | 野積み | 拡散 (🧪化学イオン、🔥熱)、対流(🧪物質、🔥熱)、 🖱 泳動(🧪イオン) | |
| 液体 | タンク 1 ) | 拡散(🧪化学イオン、🔥熱)、対流(🧪物質、🔥熱)、 🖱 泳動(🧪イオン) | ||
| 気体 | タンク 2 ) ・ ボンベ | 拡散(🧪化学イオン、🔥熱)、対流(🧪物質、🔥熱)、 🖱 泳動(🧪イオン) | ||
| エネルギー | 電池 | 送電(電気)、輻射(🔥熱、🌟光) | ||
| 情報 | ダウンロード・記録 | ストリーミング配信・ 通信 | ||
| カネ | 預貯金 | |||
ヒト、カネ、モノ、情報、エネルギー。 サプライチェーンの役者たちは、とまっているか、動いているか。
時間。 静的か、動的か。 ためておくか、動かすか。 平衡論か速度論か。 コンデンサか抵抗か。
動かすにはエネルギーが必要。
電池は、化学エネルギーを電気エネルギーに変換するデバイスです。
| 🧪 化学 | ⚡ 電力 | 💪 力学 | 🌟 光 | 🔥 熱 | |
|---|---|---|---|---|---|
| 🧪 化学 ( G ) | 化学反応 |
👨🏫
二酸化炭素センサー
湿度センサー
|
◇ 鉄砲 ( 火薬) | 👨🏫 化学発光 | 👨🏫 燃焼 バーナー ◇ 暖炉 ◇ 燃料 |
|
⚡電力
eV, FE |
◇ 蓄電池 (電解) | 変電、 インバータ |
👨🏫
モーター
4
)
🔊スピーカー |
◇ LED |
👨🏫
ヒーター
電気炉
Q=I2R |
| 💪 力学 (pV) | ◇ 高圧合成 |
👨🏫
発電機
🎤マイク |
リンク、カム | ◇応力発光 | 👨🏫 ヒートポンプ pV=nRT |
| 🌟 光(hν) | ◇ 光合成 銀塩写真 フォトレジスト |
👨🏫
太陽電池 イメージセンサー |
◇蛍光 | 👨🏫 ◇ 電子レンジ | |
| 🔥 熱(RT, kB T) | ◇ 加熱合成 | 👨🏫 熱電変換 温度センサー |
👨🏫
🚂
熱機関
pV=nRT |
◇
白熱電球
( 黒体放射) |
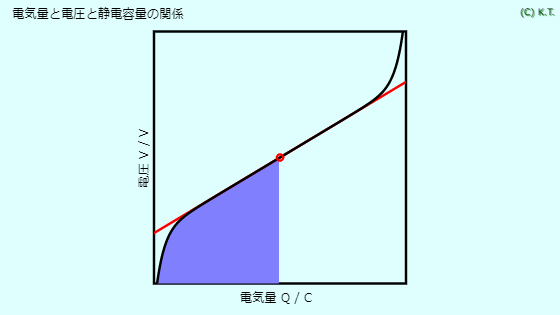
理想的なコンデンサ(キャパシタ)では、電圧は電気量に比例します。
その比例計数が静電容量です。
理想的な電池では、電圧は一定です。なので静電容量は∞です。
実際の電池では、
固定価格買い取り制度、 H2V マイクロ水力発電の 問題点 揚水式なならどうよ。 マイクロ水力発電 フライホイールもあるよ。エネルギー密度低いよ。
物質と物質が接触すると、反応したがっている気持ちが電位となって現れます。 これを電池の起電力と言います。
錆びにくい金属を貴金属と言います。 イオン化傾向は、金属と金属イオンの平衡反応の酸化還元電位に関係があります。 電位が卑なほど、 腐食しやすく、 還元しにくくなります。 電位が貴なほど、 腐食 しにくく、還元しやすいです。
イオン化傾向の大きな物質と、小さな物質の組み合わせです。
電池から電流を取り出すことを放電と言います。 充電できる電池を二次電池または蓄電池と言います。 6 )
今日、実用電池と呼ばれるもののほとんどが、 正極活物質には金属酸化物を、 負極活物質 に亜鉛を用いていること、電解液には アルカリ溶液(KOH)を用いること、 電池の名称に正極活物質の金属名を利用していることなどがわかる。 7 )
| 電池式 | Zn | KOH | MnO2 , C | Ni |
| カソード 反応(正極) | 2MnO2+ 2H2O+ 2e- → 2MnOOH+2OH- Eº = 0.215V |
| アノード 反応(負極) | Zn(OH4)2- +2e- ← Zn+4OH- Eº = -1.285V |
| 全反応 | 2MnO2+ Zn+ 2H2O+ 2OH- → 2MnOOH+ Zn(OH4)2- |
| 起電力/V | Eº = 1.5V (公称電圧) |
| 理論容量 ( 電力原単位 ) | 224.0mAh/g |
| 理論重量エネルギー密度 9 ) | 336.0mWh/g |
| 形状・寸法 | 円筒(AM3、AM4)、ボタン(LR44) |
| 用途 | リモコン、電動ハブラシ、玩具、懐中電灯、時計 |
1950ぐらいから。
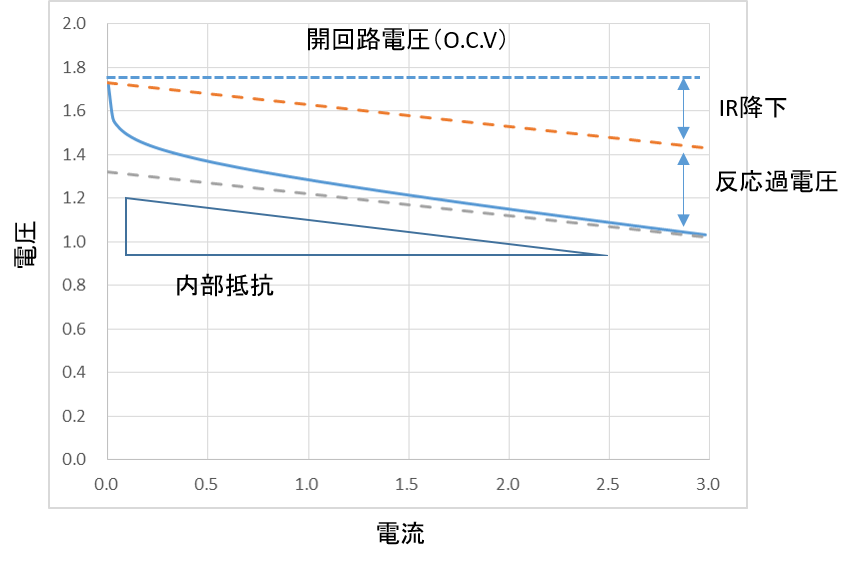
電池の電圧Voは、電池の起電力Ve.m.f.から、過電圧ηを引いたものです。
もし、過電圧ηが、電流に比例するなら、その比例係数は、 内部抵抗rと呼ばれます。
263重量エネルギー密度=エネルギー÷重量
エネルギー=電池の起電力× 電池容量(支配活物質)
電池容量(支配活物質)=支配活物質の物質量×反応に関与する電子数
電池活物質が100%反応したときの電気量を理論容量と言います。
理論容量 :電池活物質が100%反応したときの電気量これはファラデー定数を式量で割れば求めることができます。 慣例的に電池の電気量は、〔mAh〕で表現されます。 ファラデー定数は、慣例的に〔C/mol〕で表現されますが、 ここでは、〔mAh/mol〕で表現した方が、計算に便利です。
96485.332 〔 C/mol 〕 は、アボガドロ数×電気素量で、それらはSIで定められた 定義定数 です。
工業的には、 26.801 〔 Ah/mol 〕をよく使います。
ファラデー定数は、 エネルギー密度や理論容量の計算にも使います。
でも二酸化マンガンは、MnO2-xのように 非量論化合物なので、厳密に式量は定義できない。 電池で使う活物質は、非量論化合物が多い。
電池活物質の式量Fw/g/molリチウムイオン電池の 10 ) の正極として使われる コバルト酸リチウムの式量は、97.873である。 よって、理論容量は、273.9mAh/gとなる。 でもコバルト酸リチウムは、厳密には、酸化してはじめて正極活物質となる。 その場合式量としてリチウムが抜けた状態の量を使って282.6mAh/gとなる。 実際には100%リチウムを抜くことはできない。 そこで慣例的に、コバルト酸リチウムを正極活物質として計算することが多いようである。*
| 式 | 説明 |
|---|---|
|
電気エネルギー Eは、電気量Qの関数であるところの作動電圧Voを電気量で積分して得る。 理想的な電池では、電気量Q=電池容量× SOCである。 電気量Qは、電池では容量とも言われる。静電容量〔F〕と 電池容量〔Ah〕は単位が違うので注意。 電池の理論容量は、活物質の物質量に比例する(ファラデーの電気分解の法則)。 |
|
| 作動電圧(Q)は、電池の起電力(Q)から電流の関数であるところの過電圧を差し引いて得る。 | |
| 電流と電気量の関係を使って、全て電気量で記述できる。 | |
| 過電圧が、 電池の内部抵抗だけで近似できるなら、 | |
|
作動電圧(Q)=
電池の起電力(Q)±過電圧(I) 電流は電気量の時間微分なので、 作動電圧(Q)=電池の起電力(Q)±過電圧(dQ/dt) |
電池の単位重量当たりの電気エネルギーを重量エネルギー密度、 電池の単位体積当たりの電気エネルギーを体積エネルギー密度と言います。


実用金属のほとんどが正極活物質に金属酸化物、負極活物質に亜鉛、電解液にアルカリ溶液が使われている。それはなぜか?
化学工学とリチウム電池~分散・スラリーの作成と塗布乾燥~. 山形大学, 電気化学特論 講義ノート, 2018. https://edu.yz.yamagata-u.ac.jp/developer/Asp/Youzan/@Lecture.asp?nLectureID=4045 , (参照 ).
| 電池 | 電池式 | 性質や特色 | |
|---|---|---|---|
| 歴史的電池 |
1800
ガルバノ電池 (ボルタ電堆) |
Zn|H2SO4aq|Cu | 銅は単なる集電体。正極活物質は酸素。 |
| ダニエル電池 | Zn|Zn2+aq||Cu2+aq|Cu | 正極活物質と負極活物質が分離。集電体は反応系を兼用 | |
| 一次電池 | 1888 乾電池 11 ) | Zn|NH4Claq|MnO2, C|C | 正極活物質に酸化物(固体)とバインダーを採用。正極合材。 負極活物質の 亜鉛は両性金属なので、アルカリに溶けてしまう。 |
| 1950 アルカリ乾電池 | Zn | KOHaq | MnO2 ,C | Ni | ||
| 1970 リチウム電池 | Li | LiClO4,PC | MnO2,C | SUS304 | 有機電解液 採用。 | |
| 二次電池 | 1991 リチウムイオン電池 12 ) | (-) Cu | C | LiPF6,EC+DEC | LiCoO2, C | Al (+) | |
| 鉛電池 | 鉛は両性金属だが、硫酸には溶けない。 | ||
| ニカド電池 * | Cd|Cd(OH)2|KOH aq|NiOOH | 亜鉛と違って カドミウムは両性金属でないのでアルカリに溶けない。 | |
| ニッケル水素電池 | MH|KOH aq|NiOOH | 水素吸蔵合金はアルカリに溶けない。 | |
イタリアの解剖学者Lugi Galvani(1737-1798)は、蛙の解剖に端を発した二つの異種金属を接触させたときに流れる電流を動物電気と称した(1979)。 この現象は直ちに同国のAlessandoro Count Volta(1745-1827)により追試され、ボルタの電堆として実証された(1800年3月)。 Galvaniの業績をたたえてこの種の電池を ガルバニ電池と呼んでいる。
電池の体積=寸法できまる。
支配活物質の体積+従属活物質の体積+その他の部品の体積
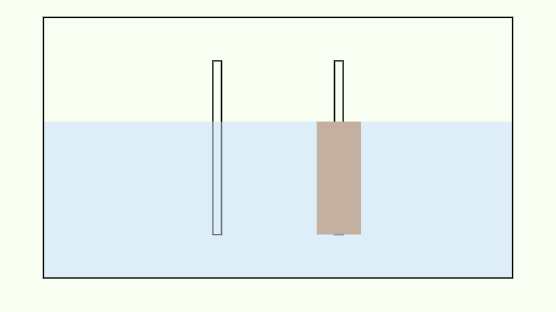
電池には長い 歴史があります。 中でも乾電池ときたら横にしても液がこぼれないんですから!すごいですねー、便利ですねー。 ここではその原理をビーカーセルで学びます。

【製品】発光ダイオードを明るく長持ち、 アルカリマンガン乾電池 正極活物質として、電解二酸化マンガンを用いる。活物質30mgにグラファイト30mgを良く混ぜ、 テフロン分散液を専用駒込めピペットで2~3滴加えて乳鉢上で良く混練し、 ラバー状とし正極合剤とする。正極集電体としてニッケル(Ni)を用い、 この集電体の先端に正極合材を落ちないようになすりつけて試料電極とする。 電解液に9M KOH5mLをビーカーに入れ、対極に亜鉛(Zn)を用いて電池を作成する。 この電池を2個直列繋ぎにし、並列繋ぎにした発光ダイオードを点灯させ、時間とともに電圧がどのように変化するかを記録する。 濃アルカリが眼に入ると失明の恐れがあるので保護眼鏡などを着用して実験する。 /
Ni | MnO2 ,C | KOH | Zn ?設問:取り出せたエネルギーは何Jか? それは活物質の量に対して何%か? ?設問:実用化されている電池の種類とそれらの電池を利用する工業製品をあげよ。 正極合材の調整(左図) 電解セル(中央図) 点灯したLED(右図)
ピカッとさいえんす 宇宙へ行った電池 現代の電気化学、p.75 最新工業化学、p.44二酸化マンガンの還元(アルカリ乾電池). 山形大学, 化学実験Ⅰ 講義ノート, 2018. https://edu.yz.yamagata-u.ac.jp/developer/Asp/Youzan/@Lecture.asp?nLectureID=4720 , (参照 ).


アルカリ乾電池の構造を図解し、写真に撮ってアップロードしなさい。
| 種類 | 量 | 説明 |
|---|---|---|
| 情報 | 100TB | 動画(約120分)×1000本×100人ぐらい 2TB×40+4TB×12+600GB×17, キャッシュ用SSD |
| 最大電力 | 1600W | 設計最大消費電力,家庭用 〇電子レンジ2台分 |
| 実測電力 | 1600W | ←設計最大消費電力(DB接続不可のため) |
| ⚡年間電力量 (電気エネルギー) |
14025.6kWh | |
| 年間電気代 | 420768円 | 1kWhあたり30円で算出 |
| 年間排二酸化炭素 | 7.2792864t | 東北電力の基礎排出係数0.000519tCO2/kWhより算出 |
| ソーラーパネル面積 | 24㎡ | 1kWあたりに必要なおおよその面積を15㎡として算出 |
| リチウムイオン電池 | 15kWh | 家庭用蓄電池1台分 |
学術情報基盤センター https://ftp.yz.yamagata-u.ac.jp/運用実績より。 通信速度は、実質1Gbps平均です。設計上の最大速度は5Gbpsです.
キャンパスのユーティリティとしての 学術情報基盤センターが消費する電力。
備忘。 7号館のパネルの面積は,忘れました.図面見て計算します. 10kW分のパネルです.7号館は,10kWのシステムが4台,並列でつながっています<パワコン4台 そのうちの1台が 学術情報基盤センター 米沢分室に送電されています.太陽光の電池は, リチウム電池15kWhです44,730,000円
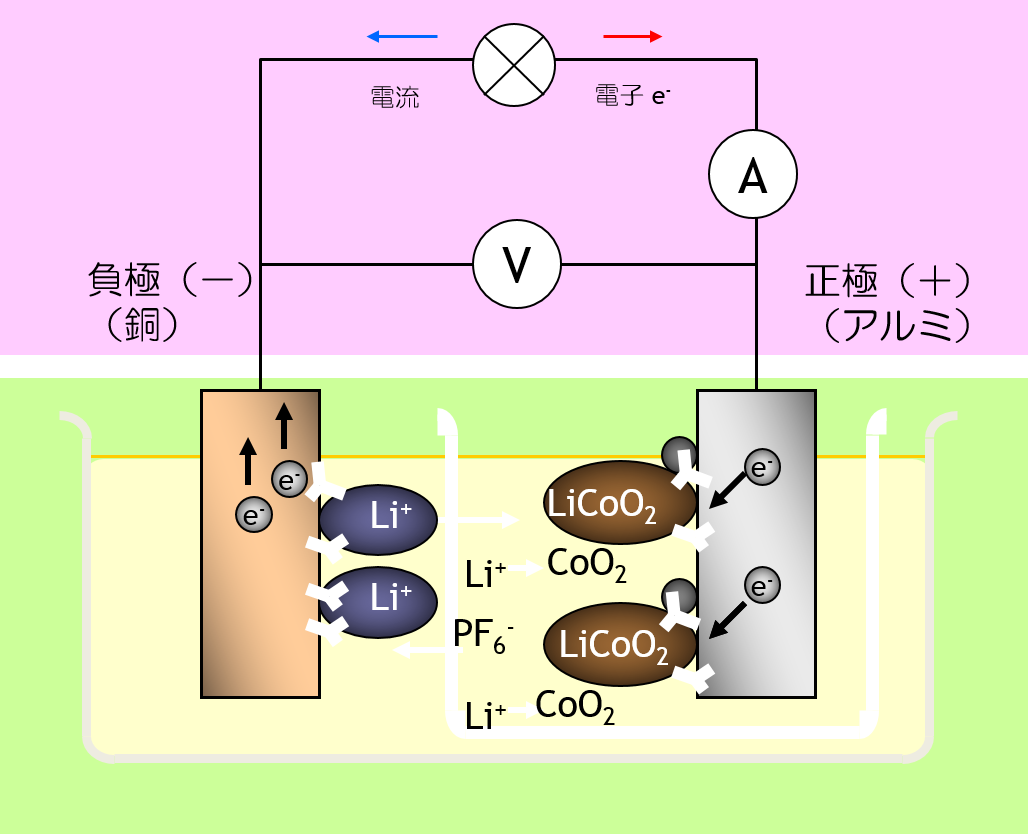
リチウムイオン二次電池 では、 正極活物質も 負極活物質も、 固相反応にすることでカタチが変形を最小限にしています。 しかし、反応生成物の化学組成が違う以上、密度が変化するので、カタチの変形から逃れることはできません。 カタチの変形によって、固体と固体の 接触状態が変わるため、 電池の内部抵抗の増大の原因になります。
| 電池式 |
組み立て後:Cu|C|LiPF6 EC+DEC|LiCoO2
,C|Al 充電後:Cu|C6Lix|LiPF6 EC+DEC|Li1-xCoO2 ,C|Al |
| 負極 反応 | 6C+xLi++xe-=C6Lix Eº = -3V |
| 正極 反応 | LiCoO2=xLi++xe-+Li1-xCoO2 Eº = 0.7V |
| 全反応 | |
| 起電力/V | 3.7 (公称電圧) 18650リチウムイオン電池は1セルの公称電圧が3.6Vまたは3.7V |
| 最低放電終了電圧/V | 2.5~2.75V |
| 実用電池容量/mAh | 1200~3300mAh |
| 理論電池容量/mAh | |
| サイクル寿命/回 | |
|
理論重量容量密度
( 理論容量 ・ 電力原単位 ) /mAh/g |
157.7mAh/g |
|
理論重量エネルギー密度
/mWh/g |
583.5 |
| 実用 重量エネルギー密度 | 200~250Wh/kg 程度 * |
| 形状・寸法 | 円筒型 (18650の例 18は直径18mm、65は長さ65mm、0は円筒形) 2170や4680も * * 、 ラミネート型 |
| 重量 | |
| 用途 | 住宅、 自動車、 スマホ |
17 ) https://led-outdoorgear.biz/wp/18650-pse/ F=96485.33212331


リチウム電池を二次電池にする工夫について述べなさい。
反応前後の体積変化、エントロピー変化
競合反応存在、不可逆性、電流効率
平方根測
電池の内部抵抗 が大きくなると、カットオフ電圧に到達する時間が短くなり、電池の容量が小さくなります。 電池の内部抵抗 は、溶液抵抗( 抵抗過電圧)と接触抵抗からなります。 接触抵抗は、オーミックコンタクトでは、固体間接触の集中抵抗からなり、 またショットキーコンタクトでは、反応抵抗( 活性化過電圧)や皮膜抵抗となります。 SOCの推定に使われます。
👨🏫 電池の内部抵抗とSOC- OCV曲線| 電圧 | 内容 | |||
|---|---|---|---|---|
| 危険 | 5.00 | 安全弁解放 | ||
| 4.25 | 保護回路作動電圧 | |||
| 注意 | 4.20 | 使用上限電圧 | ||
| 適性 | 4.15 | カットオフ上限電圧 | ||
| 3.30 | カットオフ下限電圧 | |||
| 注意 | 3.00 | 使用下限電圧 | ||
| 危険 | 2.40 | 保護回路作動電圧 |
充電や放電での電池管理(BMS)では、 カットオフ電圧の検知が大切です。 カットオフ電圧が0.01V違うと、副反応のリスクが急激に増大します。 特に ADCの精度が低いと危険です。 電池の内部抵抗は、 正極、負極、電解質の 過電圧によります。


豆電球を点灯したときの電池の電圧降下を実測しよう。


リチウムイオン二次電池の電圧効率、電流効率について議論し、電池効率を向上させるにはどうしたらいいか述べなさい。
このマークは本説明資料に掲載している引用箇所以外の著作物について付けられたものです。
銅めっき 米沢高等工業学校本館から 銀電量計を探してみよう。
アノードもカソードも銅だったら、理論分解電圧は何Vになるか?