 🏠
🏠
 🏠
🏠
| 電池 | 電池式 | 性質や特色 | |
|---|---|---|---|
| 歴史的電池 |
1800
ガルバノ電池 (ボルタ電堆) |
Zn|H2SO4aq|Cu | 銅は単なる集電体。正極活物質は酸素。 |
| ダニエル電池 | Zn|Zn2+aq||Cu2+aq|Cu | 正極活物質と負極活物質が分離。集電体は反応系を兼用 | |
| 一次電池 | 1888 乾電池 1 ) | Zn|NH4Claq|MnO2,C|C | 正極活物質に酸化物(固体)とバインダーを採用。正極合材。 負極活物質の 亜鉛は両性金属なので、アルカリに溶けてしまう。 |
| 1950 アルカリ乾電池 | Zn | KOHaq | MnO2,C | Ni | ||
| 1970 リチウム電池 | Li | LiClO4,PC | MnO2,C | SUS304 | 有機電解液 採用。 | |
| 二次電池 | 1991 リチウムイオン電池 2 ) | (-) Cu | C | LiPF6,EC+DEC | LiCoO2,C | Al (+) | |
| 鉛電池 | 鉛は両性金属だが、硫酸には溶けない。 | ||
| ニカド電池 * | Cd|Cd(OH)2|KOH aq|NiOOH | 亜鉛と違って カドミウムは両性金属でないのでアルカリに溶けない。 | |
| ニッケル水素電池 | MH|KOH aq|NiOOH | 水素吸蔵合金はアルカリに溶けない。 | |
イタリアの解剖学者Lugi Galvani(1737-1798)は、蛙の解剖に端を発した二つの異種金属を接触させたときに流れる電流を動物電気と称した(1979)。 この現象は直ちに同国のAlessandoro Count Volta(1745-1827)により追試され、ボルタの電堆として実証された(1800年3月)。 Galvaniの業績をたたえてこの種の電池を ガルバニ電池と呼んでいる。

電池の起電力はどこから来るのか。それは界面電位差でした。横軸に距離、縦軸に電位をとったグラフを電位プロファイルと言います。電位は場所の関数なので、それをどこかの軸に沿って断面を見たグラフと言っていいでしょう。
イオン化傾向の大きな物質と、小さな物質の組み合わせです。
電池から電流を取り出すことを放電と言います。 充電できる電池を二次電池または蓄電池と言います。 7 )
今日、実用電池と呼ばれるもののほとんどが、 正極活物質には金属酸化物を、 負極活物質 に亜鉛を用いていること、電解液には アルカリ溶液(KOH)を用いること、 電池の名称に正極活物質の金属名を利用していることなどがわかる。 8 )
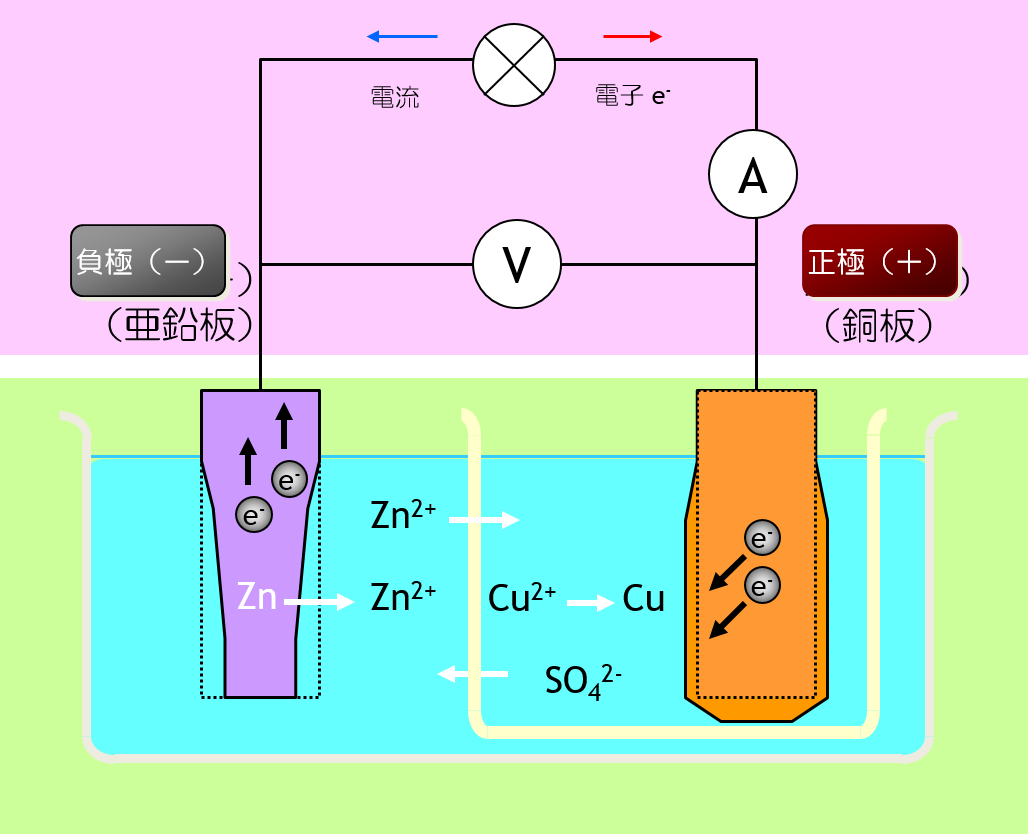
| 電池式 | Zn | ZnSO4aq || CuSO4aq | Cu |
| 負極 反応 | Zn2+ + 2e- ← Zn Eº = -0.7626V |
| 正極 反応 | Cu2+ + 2e- → Cu Eº = 0.34V |
| 全反応 | Zn +Cu2+ → Zn2+ + Cu |
| 起電力 | e.m.f. = 1.1026V |
起電力は、電解液中の亜鉛イオンと銅イオンの活量が1であるとしたときの起電力です。 関与する化学種の活量を全て1としたとき、起電力は、酸化還元電位の差になります。
*ガルバーニ電池、 ボルタ電堆、 ダニエル電池と発展します。
ダニエル電池では、正極も負極もカタチが変形するのです。 しかも、カタチの変形が可逆でないのです。 可逆でないカタチの変形は、充電式電池(二次電池)にとって、致命的です。
正極内部抵抗から見るリチウムイオン二次電池正極材料の最適な組み合わせ,,山形大学 工学部 物質化学工学科 卒業論文.
学生実験: 電池の起電力,,山形大学 工学部 物質化学工学科 シラバス.
| 電池式 | Hg | Hg2SO4+ CdSO4 |sat. CdSO4 aq.|Cd+Hg |
| 起電力 | e.m.f. = 1.01866V |
起電力は 20℃において 1.01866V です。1990年まで、 電圧基準として使われました。
*
かつて電圧の 測定標準 10 ) として、 ウエストン電池 11 ) などが使われました。 半導体が使われるようになり 定電圧源 として利用できます。
| 電池式 | Zn | KOH | MnO2 , C | Ni |
| カソード 反応(正極) | 2MnO2+ 2H2O+ 2e- → 2MnOOH+2OH- Eº = 0.215V |
| アノード 反応(負極) | Zn(OH4)2- +2e- ← Zn+4OH- Eº = -1.285V |
| 全反応 | 2MnO2+ Zn+ 2H2O+ 2OH- → 2MnOOH+ Zn(OH4)2- |
| 起電力/V | Eº = 1.5V (公称電圧) |
| 理論容量 ( 電力原単位 ) | 224.0mAh/g |
| 理論重量エネルギー密度 | 336.0mWh/g |
| 形状・寸法 | 円筒(AM3、AM4)、ボタン(LR44) |
| 用途 | リモコン、電動ハブラシ、玩具、懐中電灯、時計 |
1950ぐらいから。
反応は可逆でも、形状が可逆とは限らない。特に負極に金属を使っている場合、放電して腐食溶解した負極が、充電によって完全に元の形状に戻ることはまずない。 少しでも形状変化を小さくするために、電池活物質には固体材料が使われることが多い。
リチウム電池を二次電池化するには、負極の充電時の形状変化を可逆にする必要がありました。 放電時に金属リチウムがリチウムイオンとして電解液に溶解すると、 充電時に元の形状に戻るとは限りません。 そこで、炭素のインターカレーション反応を利用し、負極反応を固相反応とすることで、 負極の充電時の形状変化の可逆性を実現しました。
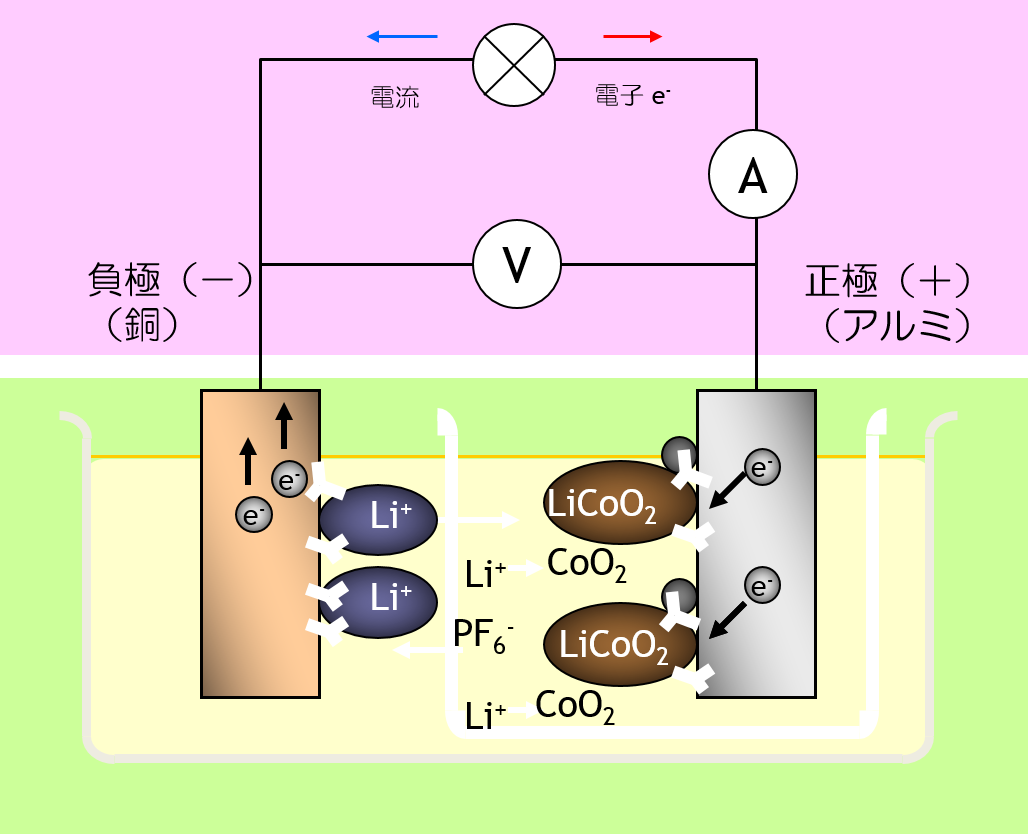
リチウムイオン二次電池 では、 正極活物質も 負極活物質も、 固相反応にすることでカタチが変形を最小限にしています。 しかし、反応生成物の化学組成が違う以上、密度が変化するので、カタチの変形から逃れることはできません。 カタチの変形によって、固体と固体の 接触状態が変わるため、 電池の内部抵抗の増大の原因になります。
| 電池式 |
組み立て後:Cu|C|LiPF6 EC+DEC|LiCoO2,C|Al 充電後:Cu|C6Lix|LiPF6 EC+DEC|Li1-xCoO2,C|Al |
| 負極 反応 | 6C+xLi++xe-←C6Lix Eº = -3V |
| 正極 反応 | LiCoO2←xLi++xe-+Li1-xCoO2 Eº = 0.7V |
| 全反応 | |
| 起電力/V | 3.7 (公称電圧) 18650リチウムイオン電池は1セルの公称電圧が3.6Vまたは3.7V |
| 最低放電終了電圧/V | 2.5~2.75V |
| 実用電池容量/mAh | 1200~3300mAh |
| 理論電池容量/mAh | |
| サイクル寿命/回 | |
|
理論重量容量密度
( 理論容量 ・ 電力原単位 ) /mAh/g |
157.7mAh/g |
|
理論重量エネルギー密度
/mWh/g |
583.5 |
| 実用 重量エネルギー密度 | 200~250Wh/kg 程度 * |
| 形状・寸法 | 円筒型 (18650の例 18は直径18mm、65は長さ65mm、0は円筒形) 2170や4680も * * 、 ラミネート型 |
| 重量 | |
| 用途 | 住宅、 自動車、 スマホ |
12 ) https://led-outdoorgear.biz/wp/18650-pse/ F=96485.33212331
電池活物質が100%反応したときの電気量を理論容量と言います。
理論容量 :電池活物質が100%反応したときの電気量これはファラデー定数を式量で割れば求めることができます。 慣例的に電池の電気量は、〔mAh〕で表現されます。 ファラデー定数は、慣例的に〔C/mol〕で表現されますが、 ここでは、〔mAh/mol〕で表現した方が、計算に便利です。
96485.332 〔 C/mol 〕 は、アボガドロ数×電気素量で、それらはSIで定められた 定義定数 です。
工業的には、 26.801 〔 Ah/mol 〕をよく使います。
ファラデー定数は、 エネルギー密度や理論容量の計算にも使います。
でも二酸化マンガンは、MnO2-xのように 非量論化合物なので、厳密に式量は定義できない。 電池で使う活物質は、非量論化合物が多い。
電池活物質の式量Fw/g/molリチウムイオン電池の 13 ) の正極として使われる コバルト酸リチウムの式量は、97.873である。 よって、理論容量は、273.9mAh/gとなる。 でもコバルト酸リチウムは、厳密には、酸化してはじめて正極活物質となる。 その場合式量としてリチウムが抜けた状態の量を使って282.6mAh/gとなる。 実際には100%リチウムを抜くことはできない。 そこで慣例的に、コバルト酸リチウムを正極活物質として計算することが多いようである。*
リチウム電池の仕組み はどうなっているのでしょうか?
電池 @C1卒業研究リチウムイオン電池は、組み立てた直後は、放電できない。 初期充電して、材料を活物質に電解合成しないと放電できないのだ。
「椅子を高く持ち上げたときに消費するエネルギーは、椅子の位置エネルギーに時間をかけて求めることができる」はほんとうか?? 問
銅の電解精錬に使う電力は何のためか?それを節電するにはどうしたらいいか?注意すべき点は何か?? 問
2024年1月21日 松木健三名誉教授がご逝去されました。