1.電気化学と電池の基本
1.1 モノに電気が流れる仕組み―電子とイオン―
クリーンに電気をためる電池
| 🧪 化学 | ⚡ 電力 | 💪 力学 | 🌟 光 | 🔥 熱 | |
|---|---|---|---|---|---|
| 🧪 化学 ( G ) | 化学反応 |
👨🏫
二酸化炭素センサー
湿度センサー
|
◇ 鉄砲 ( 火薬) | 👨🏫 化学発光 | 👨🏫 燃焼 バーナー ◇ 暖炉 ◇ 燃料 |
|
⚡電力
eV, FE |
◇ 蓄電池 (電解) | 変電、 インバータ |
👨🏫
モーター
2
)
🔊スピーカー |
◇ LED |
👨🏫
ヒーター
電気炉
Q=I2R |
| 💪 力学 (pV) | ◇ 高圧合成 |
👨🏫
発電機
🎤マイク |
リンク、カム | ◇応力発光 | 👨🏫 ヒートポンプ pV=nRT |
| 🌟 光(hν) | ◇ 光合成 銀塩写真 フォトレジスト |
👨🏫
太陽電池 イメージセンサー |
◇蛍光 | 👨🏫 ◇ 電子レンジ | |
| 🔥 熱(RT, kB T) | ◇ 加熱合成 | 👨🏫 熱電変換 温度センサー |
👨🏫
🚂
熱機関
pV=nRT |
◇
白熱電球
( 黒体放射) |
光熱費というぐらいで、光と熱になったら、なかなか使い道がないのです。
電子伝導
| 固体の分類 | 結晶 | 性質や特色 | 物質の例 | 用途 |
|---|---|---|---|---|
| 金属 | 金属( 導体 ) | ギャップ幅が狭い 金属光沢がある。 金属伝導 | 鉄、 🜠 銅、 🏞 亜鉛、 🜀 アルミニウム | 送電 |
| 半金属 | ギャップ幅が狭く、価電子帯の頂上と伝導帯の底がフェルミ準位を横切って いる | 黒鉛 *、ビスマス、アンチモン | ||
| 絶縁体 | 半導体(間接遷移型) | ギャップが比較的狭い | 🏞 ケイ素 ( 共有結合)、ゲルマニウム、炭化ケイ素 | パワーエレクトロニクス |
| 半導体(直接遷移型) | 同じ波数でのギャップが比較的狭い | ヒ化ガリウム | 発光ダイオード | |
| 絶縁体( 不導体 ) | ギャップが比較的広い | 酸化アルミニウム(イオン結合) ダイヤモンド(共有結合) | 碍子、電解コンデンサ |
電気を流すのは金属だけです。黒鉛が電気を流すのは例外です。
導体としては金属や合金が一般的であり、CuやAlなどの金属は送電用ケーブルに使用される。
最新工業化学―持続的社会に向けて―より引用
電解質(電子絶縁体)
| 分類 | 状態 | 性質や特色 | 物質の例 |
|---|---|---|---|
| 気体 | プラズマ | 電離したイオンと電子が動く | 雷 |
| 液体 | 電解質溶液 | イオン結晶が、溶媒中で、電離し、 溶媒中を溶媒和したイオンが 泳動 | 食塩水, KOH aq, LiPF6/EC+DEC |
| 溶融塩、イオン液体 | イオンが泳動 | LiCO3+KCO3 | |
| 固体 | ゲル電解質 | 溶媒で膨潤したマトリクス中をイオンが 泳動 | PVdF? |
| 固体電解質 | 固定された格子中をカチオンが半融状態で 泳動 | AgI LiF(SEI) ポリマー電解質 |
電気分解は、電解質(電子絶縁体)の絶縁破壊です。
電気を運ぶものを キャリア (担体)と言います。 キャリア には、電子、ホール(正孔)、イオン、空孔(ベーカンシー)があります。
混合伝導
電気伝導-金属、半導体、液体電解質、固体電解質-
| 化学結合の種類 | 結晶 | 性質や特色 | 物質の例 |
|---|---|---|---|
| イオン結合 | イオン結晶 | 固体 は 導電率が小さい(絶縁体)。水溶液や溶融塩は 導電率が大きい。 ( キャリア :イオン)。 | 塩化ナトリウム、塩化銀、水酸化ナトリウム |
| 共有結合 | 分子結晶 | 分子式 で表す。融点や沸点は低い。 | 酸素、アンモニア、水※1、ドライアイス |
| 共有結合の結晶 | フェルミ準位 はバレンスバンド中にあり、電子はそこに局在化している(共有電子)。 局在化した電子の負電荷と原子核の正電荷で結合している。 黒鉛や 導電性高分子は、π電子共役系の非局在化した電子により例外的に電気を通す。 | ダイヤモンド、 黒鉛、 🏞 ケイ素 水晶 、石英※2 | |
| 金属結合 | 金属の結晶 | 導電率 が大きい( キャリア : 自由電子)。 コンダクションバンド中にフェルミ準位があるので、電子が非局在化している。 | 銅、亜鉛、 🜀 アルミニウム リチウム |
※1.水分子は共有結合に分類されるが、液体の水はわずかに電離して電気を流す。 このイオン結合的な性質を、極性分子と表現する。
※2.ケイ酸塩のケイ酸はイオン結合に分類されるが、共有結合としての性質が強く、焼成などで成型することができる。


1.2 電気でモノを作る―水電解―

水電解
かつては水素は水を電気分解して得る水電解が重要なプロセスであった 4 ) 。
水電解ではなくトルエン電解?
- 有機ハイドライド電解合成法
Impress Corporation. . https://sgforum.impress.co.jp/news/4866. ,2020-9-24 ( 参照 2020-9-24 ) .
電気化学系の3要素(アノード、カソード、電解質)
電気化学系の最小単位は、一つの電子伝導体Mと一つのイオン伝導体Sの接触によって構成されます 5 ) 。 最小単位をセルと言います。電池や電解槽の最小単位です。
電解質は、電子絶縁体です。 電池で、電子絶縁破壊が起きると、電気分解です。 コンデンサでは、電子絶縁体は、誘電体です。
電極の呼び名
| 注目する量 | 電極の名称 | 説明 |
|---|---|---|
| 電位 に注目 | 正極 | 電位の高い電極、(+)プラス。 正極活物質 は、電池放電時に、酸化剤。 |
| 負極 | 電位の低い電極、(-)マイナス。 負極活物質 は、電池放電時に、還元剤。 | |
| 電流に注目 | アノード | 電流が流れ込む電極。酸化反応が起きる電極。 放電するときは負極。 充電式電池では、充電のときは正極。 |
| カソード | 電流が流れ出る電極。還元反応が起きる電極。 放電するときは正極。 充電式電池では、充電のときは負極。 |
電池には電極があります。酸化が起きる極をアノード、還元が起きる極をカソードと呼びます。 以前はアノードを陽極、カソードを陰極と呼びましたが、正極と陽極がまぎらわしいのでアノードと呼びます。 アノードは電流が外部回路から流れ込む極です。カソードは電流が外部回路へ流れ出す極です。 アノード、カソードは電流の向きに注目した呼び方です。 それとは別に正極と負極という呼び方があります。 電位の高い極を正極、電位の低い方を負極と呼びます。 正極、負極は電位の高低に注目した呼び方です。
電位プロファイル―正極と負極-
電池には電極があります。
酸化が起きる極をアノード、還元が起きる極をカソードと呼びます。 以前はアノードを陽極、カソードを陰極と呼びましたが、正極と陽極がまぎらわしいのでアノードと呼びます。 アノードは電流が外部回路から流れ込む極です。カソードは電流が外部回路へ流れ出す極です。 アノード、カソードは電流の向きに注目した呼び方です。 それとは別に正極と負極という呼び方があります。 電位の高い極を正極、電位の低い方を負極と呼びます。 正極、負極は電位の高低に注目した呼び方です。
ダニエル電池を放電するときは、負極の亜鉛が酸化して亜鉛イオンになります。 つまり負極がアノードです。 乾電池の負極も亜鉛です。 乾電池に豆電球をつないで点灯させているときも亜鉛が亜鉛イオンとなって溶け出していることになります。
電極反応と過電圧-電気分解反応と理論分解電圧-
| 電流の流れ方 | 特徴 | ||
|---|---|---|---|
| 漏れ電流 | トンネル電流で、電流が漏れる | 圧力に敏感(炭素粉末など) | |
| 絶縁破壊 | ある電圧を超えると一気に電子が雪崩れ込む。 (活性化過電圧の存在) |
電流電圧曲線(分解電圧)
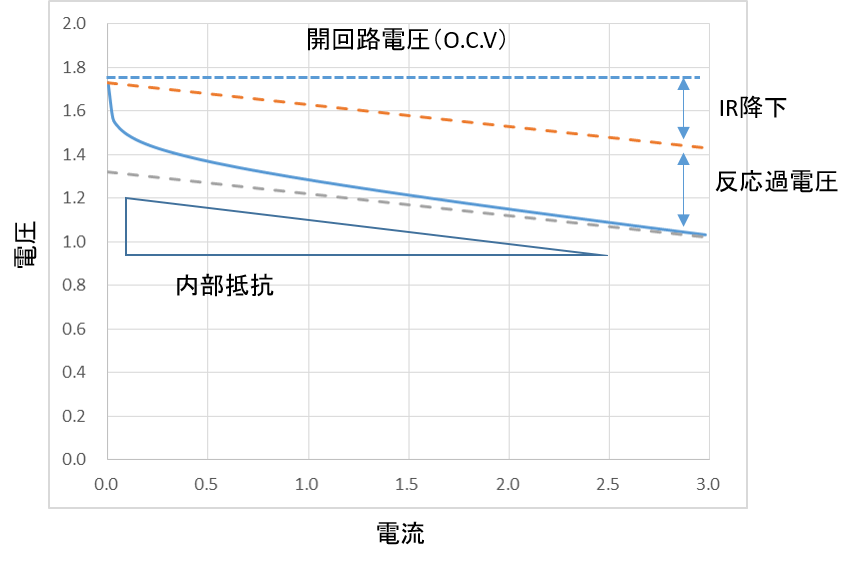
電池の電圧Voは、電池の起電力Ve.m.f.から、過電圧ηを引いたものです。
もし、過電圧ηが、電流に比例するなら、その比例係数は、 内部抵抗rと呼ばれます。
2631.3 モノから電気エネルギ-を取り出す―電池の放電―
| 電池 | 電池式 | 性質や特色 | |
|---|---|---|---|
| 歴史的電池 |
1800
ガルバノ電池 (ボルタ電堆) |
Zn|H2SO4aq|Cu | 銅は単なる集電体。正極活物質は酸素。 |
| ダニエル電池 | Zn|Zn2+aq||Cu2+aq|Cu | 正極活物質と負極活物質が分離。集電体は反応系を兼用 | |
| 一次電池 | 1888 乾電池 7 ) | Zn|NH4Claq|MnO2, C|C | 正極活物質に酸化物(固体)とバインダーを採用。正極合材。 負極活物質の 亜鉛は両性金属なので、アルカリに溶けてしまう。 |
| 1950 アルカリ乾電池 | Zn | KOHaq | MnO2 ,C | Ni | ||
| 1970 リチウム電池 | Li | LiClO4,PC | MnO2,C | SUS304 | 有機電解液 採用。 | |
| 二次電池 | 1991 リチウムイオン電池 8 ) | (-) Cu | C | LiPF6,EC+DEC | LiCoO2, C | Al (+) | |
| 鉛電池 | 鉛は両性金属だが、硫酸には溶けない。 | ||
| ニカド電池 * | Cd|Cd(OH)2|KOH aq|NiOOH | 亜鉛と違って カドミウムは両性金属でないのでアルカリに溶けない。 | |
| ニッケル水素電池 | MH|KOH aq|NiOOH | 水素吸蔵合金はアルカリに溶けない。 | |
イタリアの解剖学者Lugi Galvani(1737-1798)は、蛙の解剖に端を発した二つの異種金属を接触させたときに流れる電流を動物電気と称した(1979)。 この現象は直ちに同国のAlessandoro Count Volta(1745-1827)により追試され、ボルタの電堆として実証された(1800年3月)。 Galvaniの業績をたたえてこの種の電池を ガルバニ電池と呼んでいる。
イオン化傾向の大きな物質と、小さな物質の組み合わせです。
電池から電流を取り出すことを放電と言います。 充電できる電池を二次電池または蓄電池と言います。 13 )
今日、実用電池と呼ばれるもののほとんどが、 正極活物質には金属酸化物を、 負極活物質 に亜鉛を用いていること、電解液には アルカリ溶液(KOH)を用いること、 電池の名称に正極活物質の金属名を利用していることなどがわかる。 14 )
ダニエル電池
ガルバーニ電池、 ボルタ電堆、 ダニエル電池と発展します。
ダニエル電池では、正極も負極もカタチが変形するのです。 しかも、カタチの変形が可逆でないのです。 可逆でないカタチの変形は、充電式電池(二次電池)にとって、致命的です。
乾電池(ルクランシェ電池・屋井電池・ガスナー電池)

1.4 電池のリユース―充電式電池の課題―
リチウムイオン二次電池
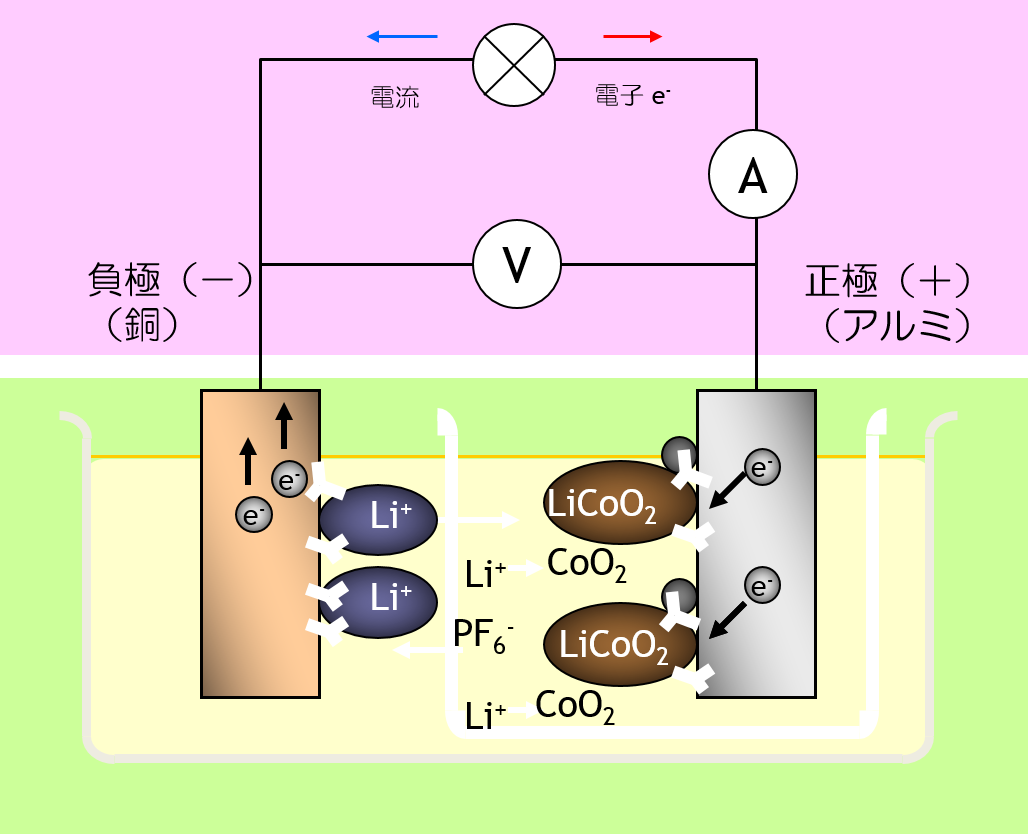
リチウムイオン二次電池 では、 正極活物質も 負極活物質も、 固相反応にすることでカタチが変形を最小限にしています。 しかし、反応生成物の化学組成が違う以上、密度が変化するので、カタチの変形から逃れることはできません。 カタチの変形によって、固体と固体の 接触状態が変わるため、 電池の内部抵抗の増大の原因になります。
1.5 モノとモノとが触れ合うところ―界面―
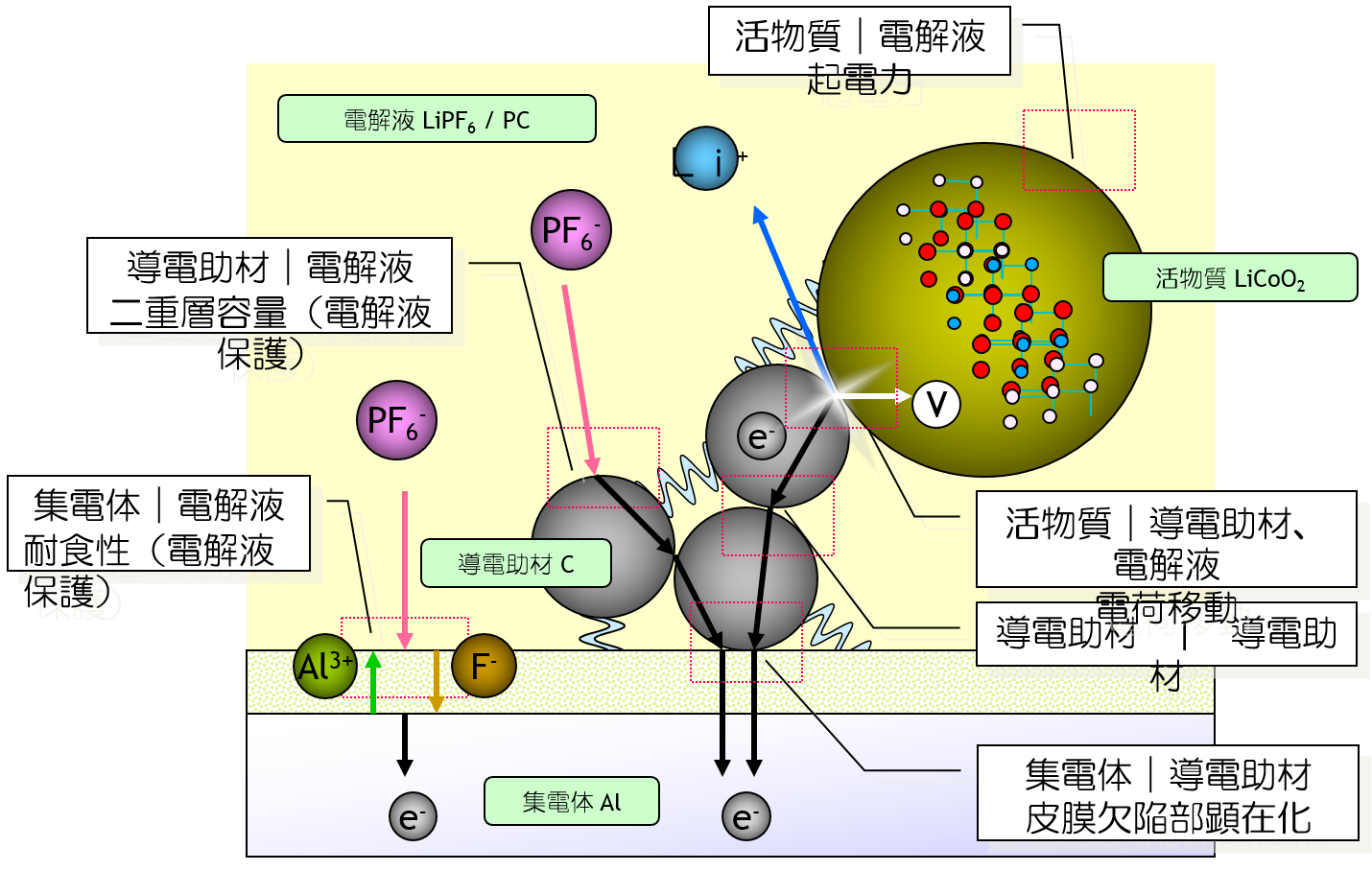
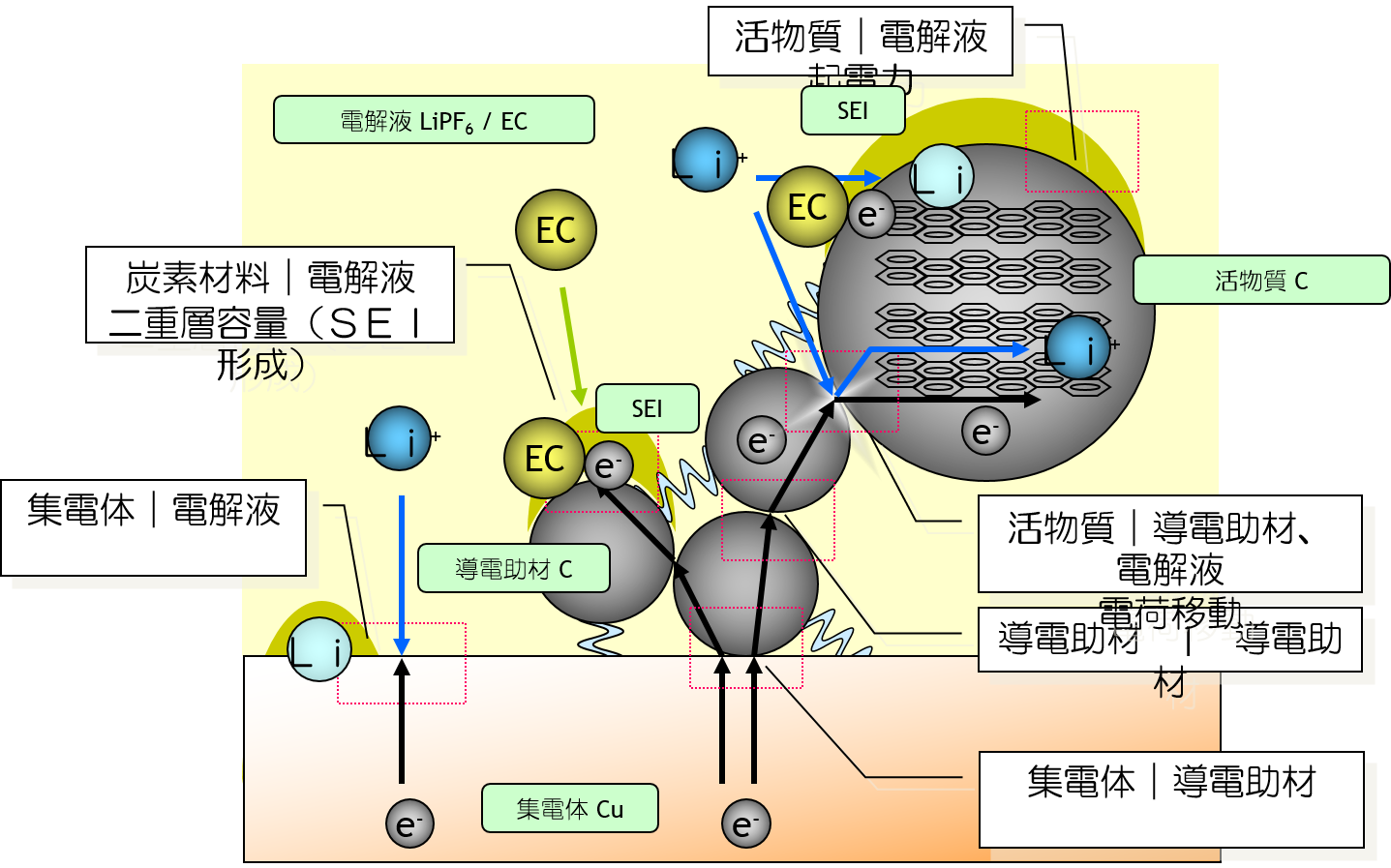
バルクと界面
電池 は、 アノード、 カソード、電解質の 三要素 からなります。 電池で起きる現象は、 電解質などの バルクの現象、 アノードやカソードといった電極と電解質の 界面の現象に、分けられます。
界面を表す 特性とバルクを表す 物性があります。等価回路ではときどき不明瞭なものがありますので、単位で確認しましょう。
たとえばバルクの測定をメインにする導電率測定の導電率計では、 界面インピーダンスを下げるため、電極に300倍もの拡面倍率を持つ白金黒電極を使います。
接触界面の種類
固体は、形状が決まっているので、接触界面に多様性がある。
| 固体 | 液体 | 気体(真空) | |
|---|---|---|---|
| 固体 |
面接触(例:
pn接合) 線接触(三相界面)(例:正極合材、 局部電池) 点接触(三相界面 ショットキー接触 )(例:固体電解質、 炭素導電助剤粒子 ) |
固液界面 (例:サスペンジョン) | 表面 |
| 液体 | 固液界面 (例:電極と電解液) | 液液界面 (例:エマルション) | 気液界面 ( 表面 ) |
| 気体(真空) | 表面 | 気液界面 ( 表面 ) | (混合) |
物質は、 様々な状態をとります。 界面や表面 は、ある材料の相と異なる材料の相が接するところです。
電池の内部抵抗は、バルクと界面との両方から生じます。
固体は、形状が決まっているので、接触界面に多様性がある。
接触抵抗 内部抵抗電池の起電力-電極界面と電極電位-
イオン化傾向
錆びにくい金属を貴金属と言います。 イオン化傾向は、金属と金属イオンの平衡反応の酸化還元電位に関係があります。 電位が卑なほど、 腐食しやすく、 還元しにくくなります。 電位が貴なほど、 腐食 しにくく、還元しやすいです。
| 界面 | 電位差 | 界面 | 例 |
|---|---|---|---|
| オーミックコンタクト | フェルミ準位が同じになるので、電位差は0 |
(固固界面)
金属|金属 |
銅|アルミニウム |
| 金属|半金属 | アルミニウム|グラファイト | ||
| 金属|半導体 | 白金|酸化チタン | ||
|
(固液界面)
金属| 電解液 |
白金|Fe2+,Fe3+/ aq | ||
| ショットキーコンタクト | 界面電位差 (起電力) |
(固液界面)
金属| 電解液 |
銅|銅イオン水溶液 |
|
(固固界面)
金属|半導体 |
ゲルマニウム|タングステン (接触ダイオード * ) | ||
| 半導体|半導体 | アルミニウム(酸化アルミニウム皮膜)|酸化マンガン(Ⅳ)、 | ||
| 金属| 固体電解質 | 金|ヨウ化銀 |
物質と 物質とが 接触すると、その 界面で電気的な相互作用が起こります。
固体同士の接触では、 点接触 になります。 しかし、製膜技術を使ってpn接合などを形成することもできます。
電極界面と起電力

電解液の溶液抵抗
1.6 固体接触は点接触―全固体電池の課題―
粒界界面の存在
粒子界面(点接触)の存在
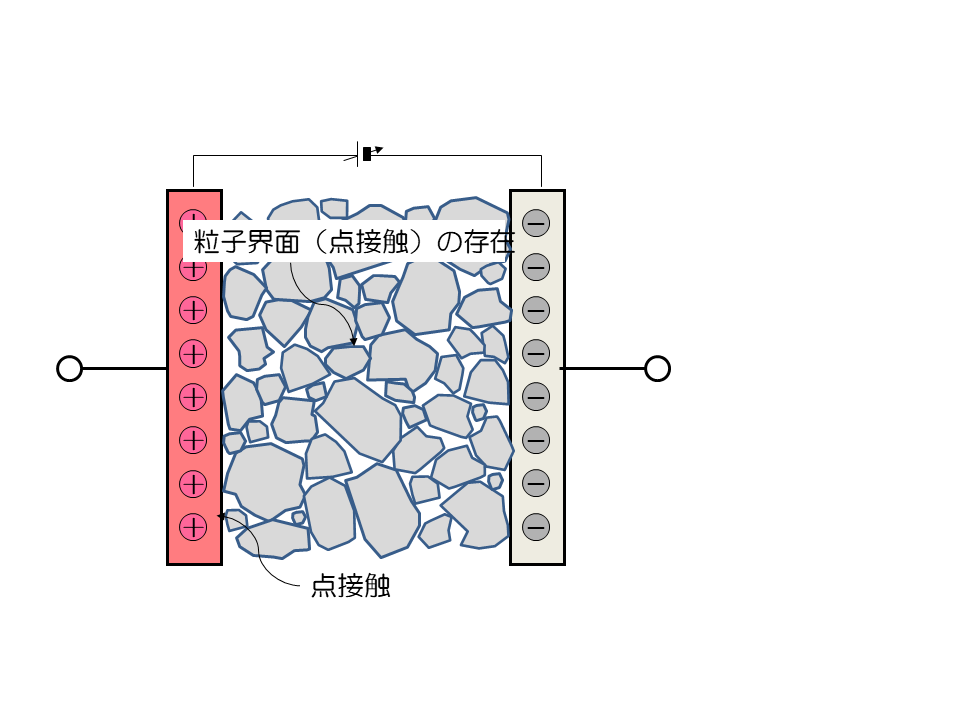
固体粒子の接触は、点接触です。面積を見積もるのがとても大変です。界面の電流密度がわかりません。 接触抵抗は電流集中( 集中抵抗)を伴うので、圧縮などの影響を受けやすいのです。活物質や炭素材料、固体電解質などの取り扱いが難しいのはそのためです。
固体粒子の接触は、点接触です。面積を見積もるのがとても大変です。界面の電流密度がわかりません。 接触抵抗は電流集中( 集中抵抗)を伴うので、圧縮などの影響を受けやすいのです。活物質や炭素材料、固体電解質などの取り扱いが難しいのはそのためです。
1.7 電池のカタチ―形状と性能―
リチウムイオン二次電池の構造
一例としてアルミニウムと銅に合材スラリーを塗布してぐるぐる巻きにした構造があります。リチウムイオン二次電池は、活物質、導電助材、バインダーなどさまざまな材料を使った部材からなります。
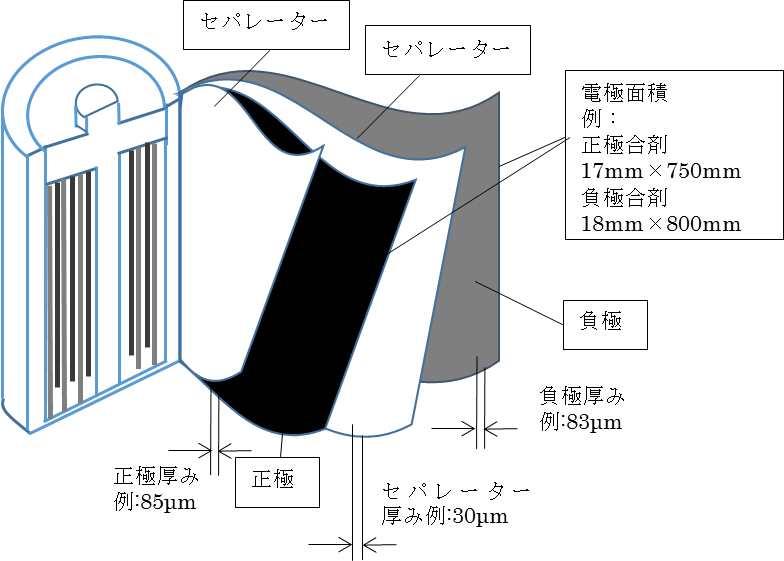
正極(放電時カソード)
負極(放電時アノード)
1.8 二酸化炭素はどこで出る?―効率と劣化―
2025年8月13日の CO2 濃度は、 推定450ppm。 この100年間で、地球大気中の二酸化炭素の 濃度は1.4倍になった。 前史時代の二酸化炭素濃度は、280ppmでほぼ一定だった。 石炭 を使い始めた産業革命から指数的に増加を始めた。 石油を使い始めてからは指数項が加わった。
日本の 炭素強度は、580gCO2eq/kWh
今、地球がヤバい。 脱炭素社会 には 再生可能エネルギー の活用が必須。そのためには、 電気エネルギーを 備蓄 する電池が必須なのだ。
- 国土交通省、気象庁 二酸化炭素濃度の経年変化 https://ds.data.jma.go.jp/ghg/kanshi/ghgp/co2_trend.html
- 東北大学大学院理学研究科 大気海洋変動観測研究センター 過去250年間の大気中二酸化炭素濃度の変動 http://caos.sakura.ne.jp/tgr/observation/co2
-
1.
◇
電気化学と電池の基本
🔁
(10:30~12:00)
- 1.1 モノに電気が流れる仕組み―電子とイオン―
- 1.2 電気でモノを作る―水電解―
- 1.3 モノから電気エネルギ-を取り出す―電池の放電―
- 1.4 電池のリユース―充電式電池の課題―
- 1.5 モノとモノとが触れ合うところ―界面―
- 1.6 固体接触は点接触―全固体電池の課題―
- 1.7 電池のカタチ―形状と性能―
- 1.8 二酸化炭素はどこで出る?―効率と劣化―
-
2. ◇
電気化学測定の基本
🔁
(13:00~14:30)
- 2.1 コイン電池の落とし穴―フルセルとハーフセル―
- 2.2 はじめに測定すること―電池の起電力と内部抵抗―
- 2.3 過電圧と電流密度―LSV―
- 2.4 反応電位と反応の可逆性―CV―
- 2.5 充電曲線と放電曲線―CP-
- 2.6 実用的な充電―CCCV-
- 2.7 初期充電の異常を見逃すな―サイクル試験―
-
3. ◇
交流インピーダンス法と材料評価
🔁
(14:40~16:10)
- 3.1 電池の特性から材料物性へ
- 3.2 直流と交流―時間と周波数―
- 3.3 等価回路の要素―電気抵抗と静電容量―
- 3.4 ボーデプロットとコールコールプロットの読み解き方
- 3.5 デジタルフーリエ変換の落とし穴―AD/DA変換―
- 3.6 電池とバッテリー-組電池―
- 3.7 バッテリマネジメントシステム(BMS)
- 3.8 データベースとビッグデータ―AI時代へ向けて―
表紙
https://edu.yz.yamagata-u.ac.jp/Public/54299/c1/Extra_Syllabus/2021_R03/20211217.asp
1.電気化学と電池の基本
https://edu.yz.yamagata-u.ac.jp/Public/54299/c1/Extra_Syllabus/2021_R03/20211217/20211217_01.asp
2.電気化学測定の基本
https://edu.yz.yamagata-u.ac.jp/Public/54299/c1/Extra_Syllabus/2021_R03/20211217/20211217_02.asp
3.交流インピーダンス法と材料評価
https://edu.yz.yamagata-u.ac.jp/Public/54299/c1/Extra_Syllabus/2021_R03/20211217/20211217_03.asp
