 🏠
🏠
 🏠
🏠
前回は 電気分解とファラデーの法則を勉強しました。
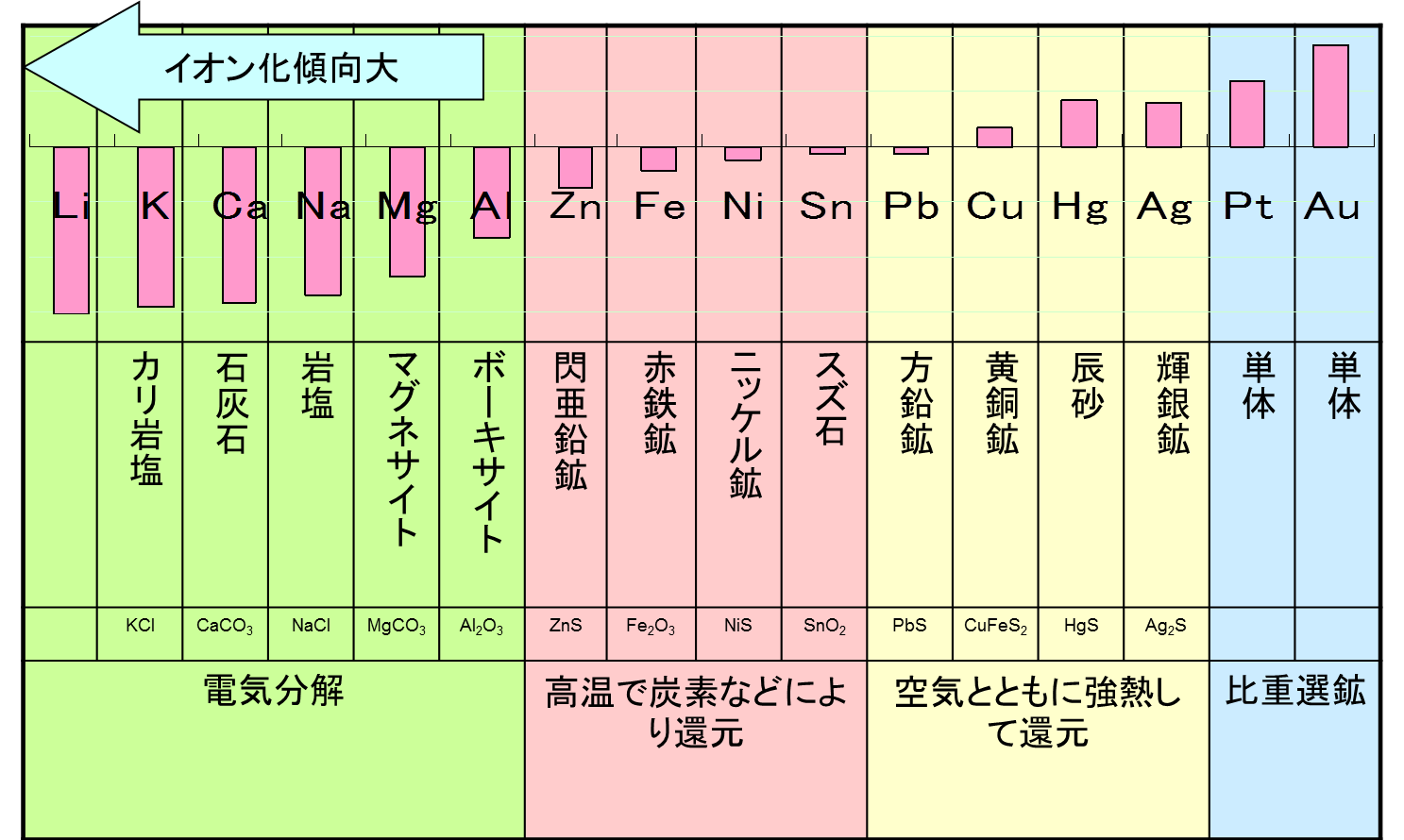
講義ノート電解液に異なる金属を触れさせると起電力が生じます。 これを電池の起電力と言います。 イオン化傾向が異なる金属同士ほど、起電力は大きくなります。 イオン化傾向が小さい金属を貴な金属と言い、イオン化傾向が大きい金属を卑な金属と言います。 電池の起電力は、正の値で表すことになっているので、貴な金属が正極となります。
甲種危険物取扱者の過去に出題された問題にもあります。
錆びにくい金属を貴金属と言います。 イオン化傾向は、金属と金属イオンの平衡反応の酸化還元電位に関係があります。 電位が卑なほど、 腐食しやすく、 還元しにくくなります。 電位が貴なほど、 腐食 しにくく、還元しやすいです。
金 も 銅 も 1000 °C くらいで溶けるのに、 鉄 ときたらそう簡単には溶けない。 炭素を溶解させて 凝固点降下 を使って融点を下げるヒッタイトの知恵。 近代製鉄は産業革命後の歴史にも大きく影響を与えた。 鉄と 石炭。 現代のコークス炉は廃プラスチックの処理にも一役買っていてさながら石油コンビナートのようだ。 海外の生産量が増す中、日本の製鉄の将来はいかに?
| 電極反応 |
電位
/ V |
/ mV/K |
/ mV/K |
|
|---|---|---|---|---|
| 2H2O + 2e- → 2OH- + H2 | -0.8285 | 0.037 | -0.834 | アルカリ性 |
| H+ + 2e- → H2 | 0.000 | 0.871 | 0.000 | 酸性 |
| O2 + 2H2O + 4e- ← 4OH- | 0.401 | -0.809 | -1.680 | アルカリ性 |
| O2 + 4H+ + 4 e- ← 2H2O | 1.229 | 0.025 | -0.846 | 酸性 |
pH0(酸性)では、1.229(酸素)-0.000(水素)≒1.23、pH14(アルカリ性)では、0.401(酸素)-(-0.8285(水素))≒1.23となって どちらも同じ1.23Vです。 電位-pH図でみると、 水の電位窓がpHによらず1.23Vです。 この1.23Vが、水電解の電解槽における水の理論分解電圧であり、酸素水素燃料電池の電池の起電力です。

てのひらに、10円と1円をのせれば、 電気化学の三要素 がそろって、電池になります。 デジタル式回路計で、 電圧を測定すると、0ではありません。 これが 電池の起電力です。 電流が流れていないにもかかわらず電圧があるのです。 電池では、電流と電圧が、そのまま比例しません。 電池は単なる電気抵抗ではないのです。 化学反応が電気を起こしているのです。 11円電池は、 ガルバニ電池と言っていいでしょう。
イオン化傾向の大きな物質と、小さな物質の組み合わせです。
電池から電流を取り出すことを放電と言います。 充電できる電池を二次電池または蓄電池と言います。 1 )
今日、実用電池と呼ばれるもののほとんどが、 正極活物質には金属酸化物を、 負極活物質 に亜鉛を用いていること、電解液には アルカリ溶液(KOH)を用いること、 電池の名称に正極活物質の金属名を利用していることなどがわかる。 2 )
| 界面 | 電位差 | 界面 | 例 |
|---|---|---|---|
| オーミックコンタクト | フェルミ準位が同じになるので、電位差は0 |
(固固界面)
金属|金属 |
銅|アルミニウム |
| 金属|半金属 | アルミニウム|グラファイト | ||
| 金属|半導体 | 白金|酸化チタン | ||
|
(固液界面)
金属| 電解液 |
白金|Fe2+,Fe3+/ aq | ||
| ショットキーコンタクト | 界面電位差 (起電力) |
(固液界面)
金属| 電解液 |
銅|銅イオン水溶液 |
|
(固固界面)
金属|半導体 |
ゲルマニウム|タングステン (接触ダイオード * ) | ||
| 半導体|半導体 | アルミニウム(酸化アルミニウム皮膜)|酸化マンガン(Ⅳ)、 | ||
| 金属| 固体電解質 | 金|ヨウ化銀 |
物質と 物質とが 接触すると、その 界面で電気的な相互作用が起こります。
固体同士の接触では、 点接触 になります。 しかし、製膜技術を使ってpn接合などを形成することもできます。

電池の起電力を簡単に測るには、ディジタル回路計を使う方法があります。 ただその場合、ディジタル回路計の入力インピーダンスが小さいと回路計に流れる電流が大きくなり平衡状態からずれてしまいます。 そこで、平衡状態を保ちながら電極電位を測定するには電位差計を使います。 電位差計は原理的にもっとも正しいのですが、現在では電子回路を使って同等の性能を示すエレクトロメーターをうのが一般的です。エレクトロメーターは、ポテンショスタットの機能として実装されていることが多いです。
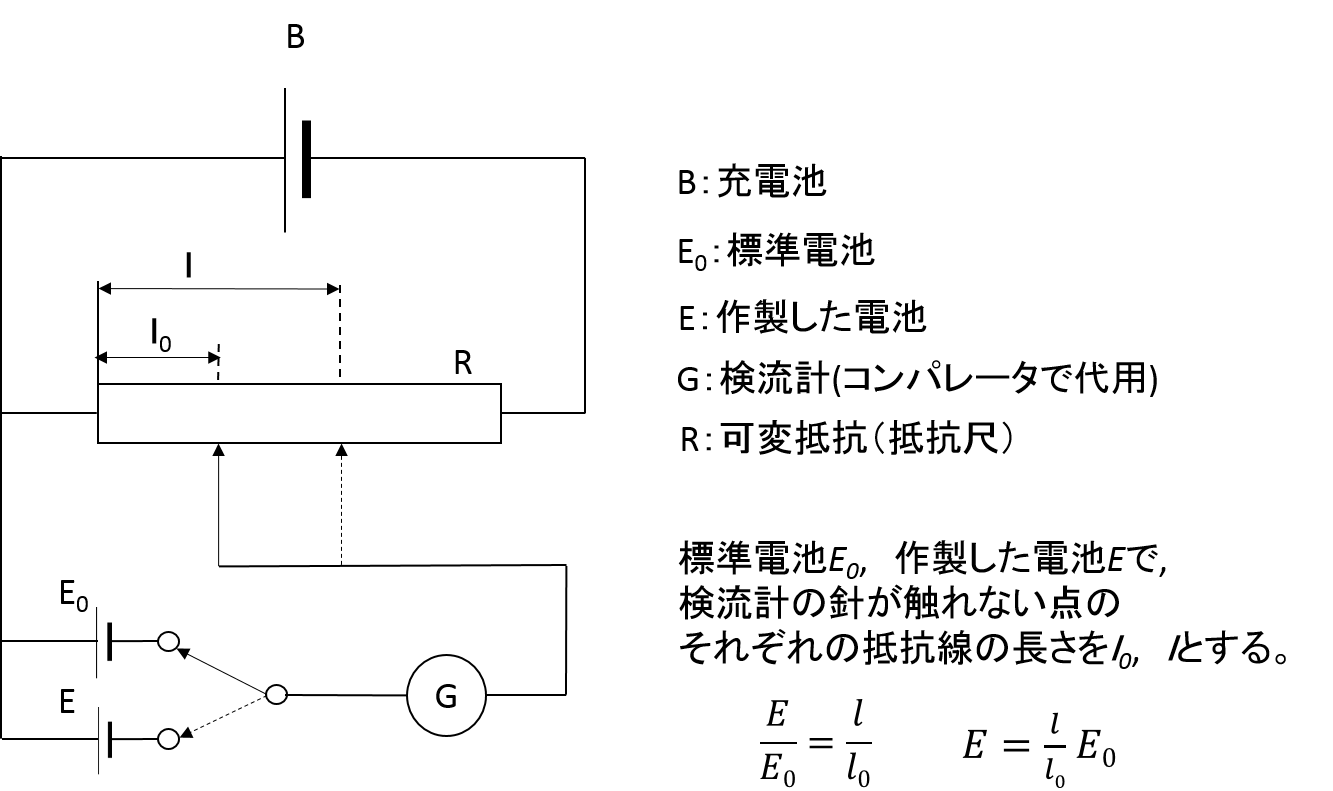
標準電池 の電圧 E0 を抵抗線の 長さ l0 に換算し、被検電池の電圧の抵抗線の 長さ l との比から、被検電池の電圧 E を 測定 します。
米沢高等工業学校本館の 電気・通信科展示室(教室)に 電位差計があります。
かつて電圧の 測定標準 6 ) として、 ウエストン電池 7 ) などが使われました。 半導体が使われるようになり 定電圧源 として利用できます。
基準電圧ICは、回路に一定の電圧の直流を供給するために用いられる電子部品です * 。 基準電圧ICから出力された5Vを抵抗分割して1Vとし、 それを オペアンプ 8 ) を使ったボルテージフォロアロアで出力しています。
回路図は、電気用図記号で表現されます。

かつて電圧の 測定標準 9 ) として、 ウエストン電池 10 ) などが使われました。 半導体が使われるようになり 定電圧源 として利用できます。
| 電池式 | Hg | Hg2SO4+ CdSO4 |sat. CdSO4 aq.|Cd+Hg |
| 起電力 | e.m.f. = 1.01866V |
起電力は 20℃において 1.01866V です。1990年まで、 電圧基準として使われました。
*| 名前 | 略号 | 説明 | |
|---|---|---|---|
| 自然電位 | R.P. | みかけの電流が流れていないときの単極電位。 三極式セル なので、 参照電極を明記すること。 | |
| 起電力 |
E
e.m.f.
Ecell
Ve.m.f.
|
電力という名前がついているけど、電池(単セル)が発生する電圧。
正極と
負極との
単極電位の差。単位はV。
ダニエル電池の
起電力は、1.1V。
|
|
| 開回路電圧 | O.C.V. | 電池( バッテリー)に電流を流さないよう、回路を切断したときのその切断箇所の両端の電圧 11 ) 。 単セル (フルセル)では、 電池の起電力とほぼ同義。 電池残量 (SOC)の推定に使われることも。 状態監視保全のため、 チェックシートで使われることも。 | |
| 閉回路電圧 | C.C.V. | 負荷をつないで電流を流したときの電圧 12 ) 。 開回路電圧より、 内部抵抗などによる電圧降下や過電圧で低くなっている。 | |
| 公称電圧 | 電池やバッテリ―では、DODや負荷によって起電力が変動するので、動作電圧の目安とする。 エネルギー密度を簡易推算するときに平均作動電圧とすることも。 |
例)銀塩化銀電極を参照電極とし、参照電極と作用電極との開回路電圧(O.C.V.)を測定し、自然電位(R.P.)を調べた。
入力インピーダンスの高い電圧計を使って、測定系に電流を流さずに電圧を測定しましょう。 まず、自分のディジタル式回路計の入力インピーダンスがいくらなのか説明書を確認してノートに書き取りましょう。 (現代の電気化学、p.14)
まず、 コイン電池 の電圧を確認してみよう。 次にふたりで協力して コイン電池 を直列につないで、その電圧を測ってみよう。
電池の歴史の中でも基本的な内容が詰まっています。実用電池の起電力を調べてみよう(現代の電気化学、p.68)
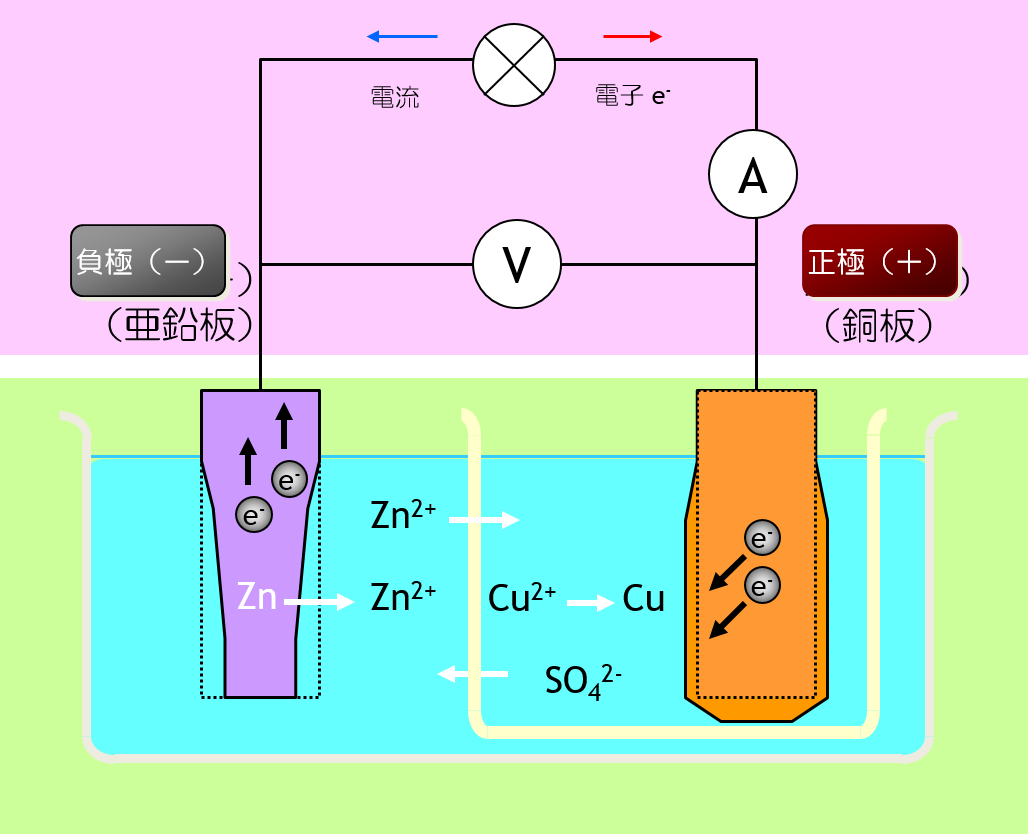
ガルバーニ電池、 ボルタ電堆、 ダニエル電池と発展します。
ダニエル電池では、正極も負極もカタチが変形するのです。 しかも、カタチの変形が可逆でないのです。 可逆でないカタチの変形は、充電式電池(二次電池)にとって、致命的です。
| 電池式 | Zn | ZnSO4aq || CuSO4aq | Cu |
| 負極 反応 | Zn2+ + 2e- ← Zn Eº = -0.7626V |
| 正極 反応 | Cu2+ + 2e- → Cu Eº = 0.34V |
| 全反応 | Zn +Cu2+ → Zn2+ + Cu |
| 起電力 | e.m.f. = 1.1026V |
| 理論容量 ( 電力原単位 ) | 415.7mAh/g |
| 理論重量エネルギー密度 14 ) | 458.4mWh/g |
起電力は、電解液中の亜鉛イオンと銅イオンの活量が1であるとしたときの起電力です。 関与する化学種の活量を全て1としたとき、起電力は、酸化還元電位の差になります。
*電池の起電力は正極と負極の組み合わせで決まります。 同じ正極を使っても負極が変われば起電力も変わります。 これだと注目している物質についての起電力の話を聞くときいちいち負極のことを尋ねなければならないので面倒ですね。 そこで、基準となる電極を定めて、その電極の電位を伝えた方がはやそうです。 注目すべき電極を作用極、基準となる電極を参照極と呼び、このような目的で作った電池を半電池と呼びます。
もっとも基準となる参照極には何がいいかな、考えて水素電極を基準とすることにしました。 水素電極と基準とした25度、1気圧、活量1の 半電池の電極電位(単極電位)を 標準酸化還元電位といいます。 銅と亜鉛の標準酸化還元電位を調べてみましょう。
純粋な金属とその金属イオンの水溶液中での標準酸化還元電位を数直線にプロットしてみましょう。 (現代の電気化学、p.94) またステンレスなど実用的な金属の海水中における電極電位について調べてみましょう。 電子を受け取りやすい金属ほど、高い電位を示しているのが見てとれますか? まあ、電子は負電荷を持っているので、正の電位にあればあるほど電子を受け取りやすいということは言うまでもないことですけど。 電子を受け取りやすいということは還元されやすいということ、 つまり、電位が高いということは還元されやすい物質であるということです。 電位の高低と酸化と還元の関係をしっかり把握しましょう。
| 例 | 備考 | |
|---|---|---|
| 白金電極 | 水素過電圧が小さい | |
| 金電極 | 酸素過電圧が大きい | |
| カーボン電極 | ||
| 水銀電極 | 水素過電圧が大きい | |
| その他の金属電極 | ||
| 特殊な電極 | ネサ電極(透明電極) | ITO電極、FTO電極はディスプレイに使われる * |
ITOは、 酸化インジウム(III) (In2O3) と酸化スズ(IV) (SnO2) の無機混合物です。
| 例 | 備考 | |
|---|---|---|
| 銀|塩化銀電極 | AgCl + e- ↔ Ag + Cl- Eº = 0.2223V* | 温度、 Cl-濃度に依存 |
| 水銀|塩化水銀電極 | Hg2Cl2 + 2e- ↔ 2Hg(l) + 2Cl- Eº = 0.26816V * | 温度、Cl-濃度に依存 |
| 水銀|酸化水銀電極 | HgO + H2O + 2e- ↔ Hg(l) + 2OH- Eº = 0.0977V * | アルカリ用(アルカリ電池の研究、粘土分散液の研究)、温度、OH-濃度に依存 |
| 水銀|硫酸水銀電極 | Hg2SO4 + 2e- ↔ 2Hg(l) + SO42- Eº = 0.613V * | 酸性用(鉛電池の研究、二酸化マンガンの電解合成の研究)、温度、SO42-濃度に依存 |
参照電極には電位がずれない、安定などの理由から銀塩化銀電極がよく使われます。 以前は水銀を使った電極が多かったのですが環境負荷の観点からあまり使われなくなりました。 液絡つきの参照電極が市販されています。液絡の構造や電解液の組成や濃度を確認してから買いましょう。 電位は電解液や組成や濃度、そして温度によって変わります。
銀塩化銀電極は、銀を塩酸中でアノード酸化して、銀の表面に塩化銀を生成させて作ります。 アノード酸化の条件を同じにするため、単位面積あたりの電流、すなわち電流密度を同じにすることが好ましいです。




銀塩化銀電極を応用したもっとも見かける装置はガラス電極を使ったpHメーターでしょう。

電気量が物質量に対応するとしたら、電位は物質の酸化力に対応します。厳密には酸化力は物質と物質の相対的な関係で決まるので、平衡反応に対応することになります。 とは言え Fe3+ と Fe2+ が混ざっていたら、 Fe3+ が多い方が電位が高くなります。 このことを定量的に示したのがネルンストの式です 17 ) 18 ) 。
酸化体が多いほど、酸化力(電位)が上がります。 電位は、ネルンストの式で説明されます。
電池の起電力は、充電率(State of charge、SOC) 19 ) によって変化します。 電池の過電圧も、充電率で変化します。また過電圧は、放電か、充電か、その方向でも変化します。
組電池 の電圧も、同様です。
# ■■■ OCV-SOC curve ■■■
import numpy as np
import matplotlib.pyplot as plt
import math
R=8.314 #気体定数
F=96485 #ファラデー定数
T=298 #絶対温度
E0p=0.7 # 正極の酸化還元電位/正極は、1電子反応、ネルンストの式に従うと仮定
E0n=-3 # 負極の酸化還元電位/負極は、一定と仮定
RR=0.03 # 電池の内部抵抗/一定と仮定
I=3 # 放電電流・充電電流/一定と仮定
a = np.arange(start = 0.0005, stop = 0.998, step = 0.002) # SOC の範囲
x = [100*p for p in a] # SOC の範囲
y = [E0p - E0n + R*T/F*math.log(p/(1-p)) for p in a] # OCV の計算
y1 = [p + I*RR for p in y] # 充電曲線 の計算
y2 = [p - I*RR for p in y] # 放電曲線 の計算
fig, ax = plt.subplots() # Figureオブジェクトとそれに属する一つのAxesオブジェクトを同時に作成
ax.axhline(E0p - E0n,linestyle="dashed") #電池の起電力
ax.axhspan(ymin=3.30, ymax=4.15, color="g", alpha=0.3) #推奨範囲
ax.axhspan(ymin=4.15, ymax=4.20, color="y", alpha=0.3) #電圧上限限度
ax.axhspan(ymin=3.00, ymax=3.30, color="y", alpha=0.3) #電圧下限限度
ax.axhspan(ymin=4.20, ymax=4.25, color="r", alpha=0.3) #保護回路作動
ax.axhspan(ymin=2.95, ymax=3.00, color="r", alpha=0.3) #保護回路作動
ax.plot(x, y)
ax.plot(x, y1,linestyle="dashed")
ax.plot(x, y2,linestyle="dashed")
ax.annotate('OCV-SOC curve', xy=(np.mean(x),np.mean(y)), xytext=(np.mean(x)+np.std(x)/2, np.mean(y)-0.2),arrowprops=dict(arrowstyle="->"))
ax.annotate('charge curve', xy=(np.mean(x),np.mean(y1)), xytext=(np.mean(x)+np.std(x)/2, np.mean(y1)+0.1),arrowprops=dict(arrowstyle="->"))
ax.annotate('discharge curve', xy=(np.mean(x),np.mean(y2)), xytext=(np.mean(x)+np.std(x)/2, np.mean(y2)-0.25),arrowprops=dict(arrowstyle="->"))
ax.text(0.1, 3.8, "recommended")
ax.text(0.1, 4.15, "higher limit")
ax.text(0.1, 3.2, "lower limit")
ax.text(0.1, 4.2, "danger")
ax.text(0.1, 2.95, "danger")
ax.set_xlabel("SOC / %")
ax.set_ylabel("OCV $V$ / V")
plt.show()
# ■■■ OCV-SOC curve ■■■
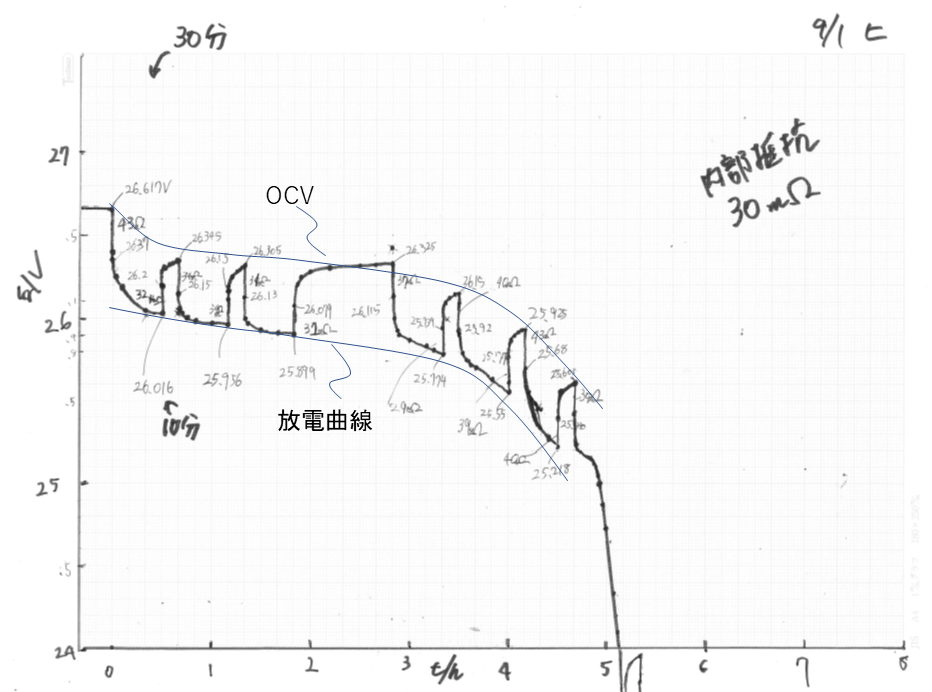
データロガーによるバッテリーの電圧の記録は以下のリンクから CSV形式でダウロードできる.
SOC_OCV
LUMOは、最低空分子オービタル。 HOMOは、最高被占分子オービタル。 基本的にHOMOが高いほど酸化されやすく(酸化還元電位が低い)、LUMOが低いほど還元されやすい(酸化還元電位が高い)。
LUMOのエネルギー準位と HOMOのエネルギー準位とのあいだに フェルミ準位があると思っていい。
Fe3+/Fe2+の半反応式は次式で表されている.この半反応式の 酸化還元電位は標準水素電極(NHE)に対し +0.771 Vである.


水は25度で1.23Vで電気分解します。標準電極電位はネルンストの式で与えられます。


電位の測定には 電位差計 を使います。 これはメートルブリッジと 標準電池 を組み合わせて被測定電池と電位が等しくなる抵抗値から電位を測定する装置です。 こうすることによって電流を流さずに電位を測定することができます。 電流を流すと電池の内部抵抗によって電圧が下がり正しい起電力が求まらなくなるからです。 逆に起電力が安定している電池は電位の較正に使うことができます。
【結果】2本の銀|塩化銀電極の電位差[V]、 ダニエル電池 の起電力の理論値[V]、Cuの単極電位[V vs.Ag|AgCl]、Znの単極電位[Vvs.Ag|AgCl]、電位数直線(横軸電位[V])と単極電位の差[V] 電気化学セルを組み立てて銀線を塩酸中でアノード酸化して1本だけ作ります。その作り方は次の通りです。銀線を紙やすりで研磨し、清浄な金属面を露出させます。その金属面を3M HNO3で前処理し、水洗いします。その電極で以下のセルを作成し、0.8mA/cm2で15分ほど電解し、表面に塩化銀を析出させます。電解セルには10mLビーカーを使います。転倒防止のため電解液を注ぐ前に底に両面テープを貼っておき、電解液を注ぎ終わったビーカーは実験台にしっかり固定します。電極はダブルクリップで固定します。
Ag
|
0.1 mol·dm-3
HCl
|
Pt
ネルンストの式を用いてできるだけ正確にダニエル電池の起電力を計算する。計算した起電力とダニエル電池を用いて、抵抗尺の目盛りを較正する(本来ならウェストン電池を用いるが、ウェストン電池は水銀やカドミウムを使用するため取り扱いに注意を要する。そこで、ここでは標準電池をダニエル電池で代用し、電位や電圧の概念を習得する)。摺動抵抗と電源には電池付き抵抗尺(NiCd電池×2)を用いる。 ダニエル電池の起電力を直接エレクトロメータ(後述のボルテージフォロア参照)に入力し、その出力が抵抗尺の同じ目盛りに対応することを確認することで、エレクトロメータの動作を確認する。(エレクトロメータはポッゲンドルフの補償法をオペアンプで電子的に瞬時に実現する装置と言える) 銀|塩化銀電極の標準電極電位を計算する*2,3)。塩化カリウム水溶液の濃度は、実測した室温から、添付資料より飽和濃度を求める。飽和塩化カリウム水溶液の濃度は非常に濃いので活量係数による補正が必要である。添付資料から活量を求めてそれを用いる*4)。以下のような電池を組み、その起電力を補償法およびエレクトロメータを用いて測定し、それぞれの単極電位の測定結果からダニエル電池の起電力を計算し、一致することを確かめる。 Cu|0.01 mol・dm-3 Cu2+||KCl|AgCl|Ag Zn|0.01 mol・dm-3 Zn2+||KCl|AgCl|Ag ?設問:参照電極の照合にはなぜデジタルテスターを用いてもよいのか? ?設問:うっかり亜鉛棒を硫酸銅につけると黒くなるのはなぜか? Cu2+ + Zn → Zn2+ + Cu ?設問:デジタル式のテスターにはなぜ電池が必要か? 標準電池としてのウェストン電池はどのようにして作成するか?
AgCl + e- ? Ag + Cl- (*)
| 化合物 | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|
| KCl | 27.8 | 30.9 | 34.0 | 35.6 | 37.1 | 40.0 | 42.9 | 45.8 | 51.2 | 56.4 |
| 物理量 | 単位 | 凡例 | |
|---|---|---|---|
| 電極電位 V | V | ||
| 起電力 V | V | ||
| 活量 a | |||
次回の電気化学は 分解電圧―電力効率とターフェルの式― について勉強しましょう。
野村正勝・鈴鹿輝男
最新工業化学―持続的社会に向けて―
講談社サイエンティフィク
松林光男、渡辺弘,
イラスト図解 工場のしくみ
,日本実業出版社
山下正通、小沢昭弥, 現代の電気化学,
丸善
,
目次
, (2012).
このマークは本説明資料に掲載している引用箇所以外の著作物について付けられたものです。
銅めっき 米沢高等工業学校本館から 銀電量計を探してみよう。
アノードもカソードも銅だったら、理論分解電圧は何Vになるか?