🏠
🏠
 🏠
🏠
2025年8月13日の CO2 濃度は、 推定450ppm。 この100年間で、地球大気中の二酸化炭素の 濃度は1.4倍になった。 前史時代の二酸化炭素濃度は、280ppmでほぼ一定だった。 石炭 を使い始めた産業革命から指数的に増加を始めた。 石油を使い始めてからは指数項が加わった。
日本の 炭素強度は、580gCO2eq/kWh
今、地球がヤバい。 脱炭素社会 には 再生可能エネルギー の活用が必須。そのためには、 電気エネルギーを 備蓄 する電池が必須なのだ。
米沢キャンパスだけで、 1500kWもの 電力を使っています。 太陽光発電で賄えるのは、 昼間の日光があるときで、せいぜい30kW。 再生可能エネルギー の太陽光だけでは、電気が全然足りません。
スマートグリッドでは、 センサーを使って電力を計測し、 インターネットの通信を使って、 発電量を制御します。 気候 に左右されやすい再生可能エネルギーでは、余剰電力を 電池 に蓄えます。
XMLでデータ交換することもできます。
| 🧪 化学 | ⚡ 電力 | 💪 力学 | 🌟 光 | 🔥 熱 | |
|---|---|---|---|---|---|
| 🧪 化学 ( G ) | 化学反応 |
👨🏫
二酸化炭素センサー
湿度センサー
|
◇ 鉄砲 ( 火薬) | 👨🏫 化学発光 | 👨🏫 燃焼 バーナー ◇ 暖炉 ◇ 燃料 |
|
⚡電力
eV, FE |
◇ 蓄電池 (電解) | 変電、 インバータ |
👨🏫
モーター
4
)
🔊スピーカー |
◇ LED |
👨🏫
ヒーター
電気炉
Q=I2R |
| 💪 力学 (pV) | ◇ 高圧合成 |
👨🏫
発電機
🎤マイク |
リンク、カム | ◇応力発光 | 👨🏫 ヒートポンプ pV=nRT |
| 🌟 光(hν) | ◇ 光合成 銀塩写真 フォトレジスト |
👨🏫
太陽電池 イメージセンサー |
◇蛍光 | 👨🏫 ◇ 電子レンジ | |
| 🔥 熱(RT, kB T) | ◇ 加熱合成 | 👨🏫 熱電変換 温度センサー |
👨🏫
🚂
熱機関
pV=nRT |
◇
白熱電球
( 黒体放射) |
光熱費というぐらいで、光と熱になったら、なかなか使い道がないのです。
| 電池 | 電池式 | 性質や特色 | |
|---|---|---|---|
| 歴史的電池 |
1800
ガルバノ電池 (ボルタ電堆) |
Zn|H2SO4aq|Cu | 銅は単なる集電体。正極活物質は酸素。 |
| ダニエル電池 | Zn|Zn2+aq||Cu2+aq|Cu | 正極活物質と負極活物質が分離。集電体は反応系を兼用 | |
| 一次電池 | 1888 乾電池 6 ) | Zn|NH4Claq|MnO2, C|C | 正極活物質に酸化物(固体)とバインダーを採用。正極合材。 負極活物質の 亜鉛は両性金属なので、アルカリに溶けてしまう。 |
| 1950 アルカリ乾電池 | Zn | KOHaq | MnO2 ,C | Ni | ||
| 1970 リチウム電池 | Li | LiClO4,PC | MnO2,C | SUS304 | 有機電解液 採用。 | |
| 二次電池 | 1991 リチウムイオン電池 7 ) | (-) Cu | C | LiPF6,EC+DEC | LiCoO2, C | Al (+) | |
| 鉛電池 | 鉛は両性金属だが、硫酸には溶けない。 | ||
| ニカド電池 * | Cd|Cd(OH)2|KOH aq|NiOOH | 亜鉛と違って カドミウムは両性金属でないのでアルカリに溶けない。 | |
| ニッケル水素電池 | MH|KOH aq|NiOOH | 水素吸蔵合金はアルカリに溶けない。 | |
イタリアの解剖学者Lugi Galvani(1737-1798)は、蛙の解剖に端を発した二つの異種金属を接触させたときに流れる電流を動物電気と称した(1979)。 この現象は直ちに同国のAlessandoro Count Volta(1745-1827)により追試され、ボルタの電堆として実証された(1800年3月)。 Galvaniの業績をたたえてこの種の電池を ガルバニ電池と呼んでいる。
ガルバーニ電池、 ボルタ電堆、 ダニエル電池と発展します。
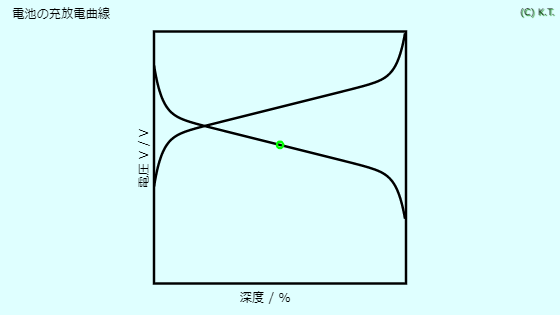
ダニエル電池では、正極も負極もカタチが変形するのです。 しかも、カタチの変形が可逆でないのです。 可逆でないカタチの変形は、充電式電池(二次電池)にとって、致命的です。
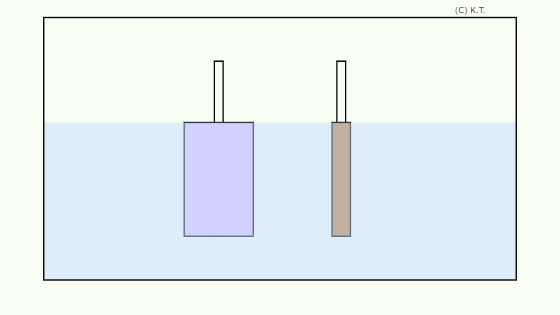

リチウムイオン二次電池 では、 正極活物質も 負極活物質も、 固相反応にすることでカタチが変形を最小限にしています。 しかし、反応生成物の化学組成が違う以上、密度が変化するので、カタチの変形から逃れることはできません。 カタチの変形によって、固体と固体の 接触状態が変わるため、 電池の内部抵抗の増大の原因になります。
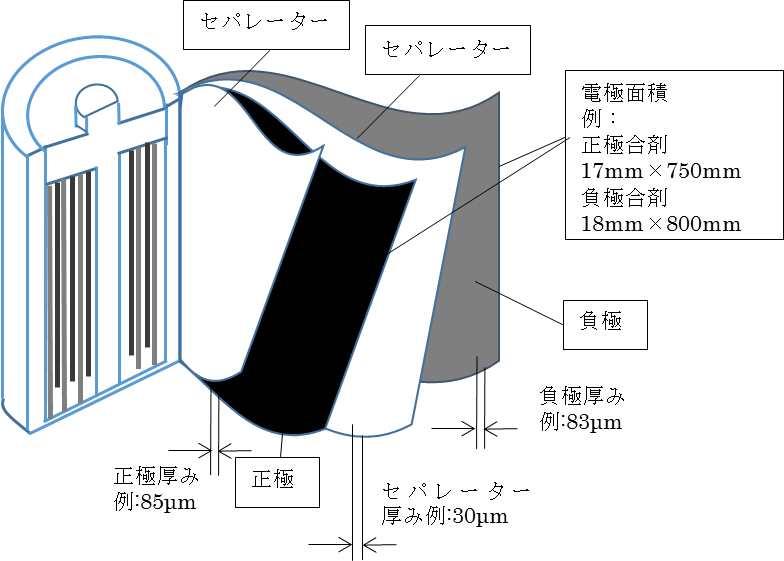
一例としてアルミニウムと銅に合材スラリーを塗布してぐるぐる巻きにした構造があります。リチウムイオン二次電池は、活物質、導電助材、バインダーなどさまざまな材料を使った部材からなります。
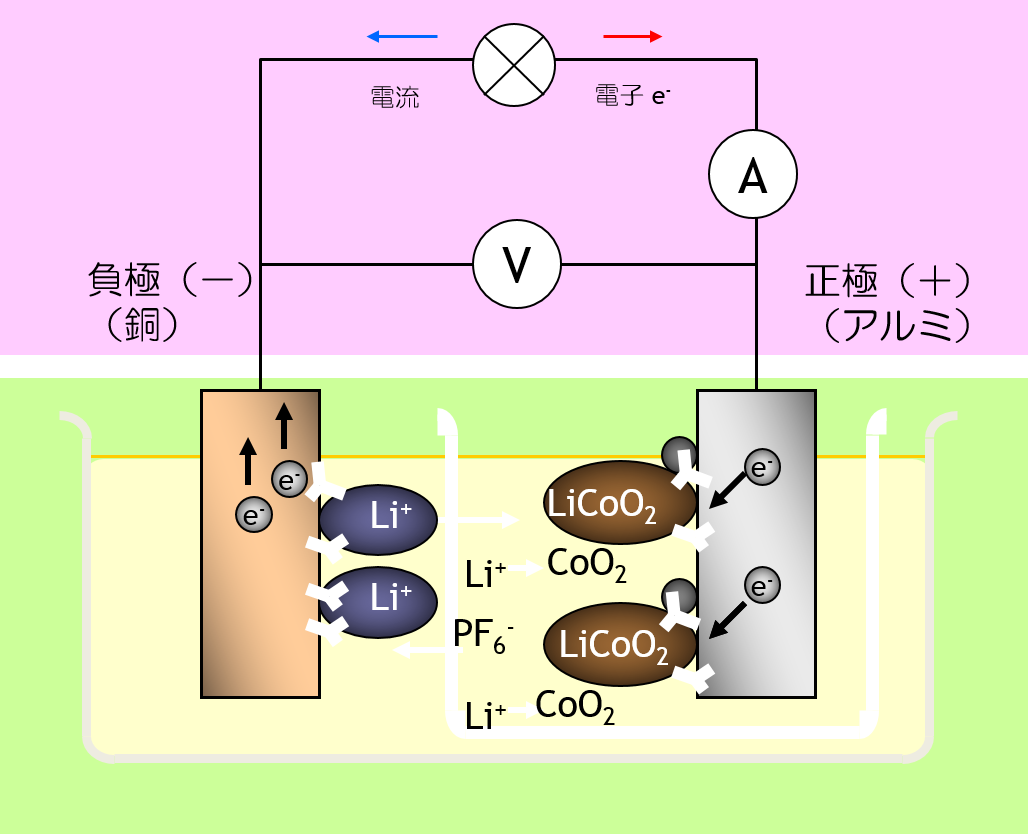
電池には電極があります。酸化が起きる極をアノード、還元が起きる極をカソードと呼びます。 以前はアノードを陽極、カソードを陰極と呼びましたが、正極と陽極がまぎらわしいのでアノードと呼びます。 アノードは電流が外部回路から流れ込む極です。カソードは電流が外部回路へ流れ出す極です。 アノード、カソードは電流の向きに注目した呼び方です。 それとは別に正極と負極という呼び方があります。 電位の高い極を正極、電位の低い方を負極と呼びます。 正極、負極は電位の高低に注目した呼び方です。
電気化学系の最小単位は、一つの電子伝導体Mと一つのイオン伝導体Sの接触によって構成されます 12 ) 。 最小単位をセルと言います。電池や電解槽の最小単位です。
電解質は、電子絶縁体です。 電池で、電子絶縁破壊が起きると、電気分解です。 コンデンサでは、電子絶縁体は、誘電体です。
電極の呼び名として電位の高低に注目した正極、負極と電流の向きに注目したアノード、カソードがあります。電解質ではイオンが動き、電解質は電子絶縁材料として働きます。
| 注目する量 | 電極の名称 | 説明 |
|---|---|---|
| 電位 に注目 | 正極 | 電位の高い電極、(+)プラス。 正極活物質 は、電池放電時に、酸化剤。 |
| 負極 | 電位の低い電極、(-)マイナス。 負極活物質 は、電池放電時に、還元剤。 | |
| 電流に注目 | アノード | 電流が流れ込む電極。酸化反応が起きる電極。 放電するときは負極。 充電式電池では、充電のときは正極。 |
| カソード | 電流が流れ出る電極。還元反応が起きる電極。 放電するときは正極。 充電式電池では、充電のときは負極。 |
電池には電極があります。酸化が起きる極をアノード、還元が起きる極をカソードと呼びます。 以前はアノードを陽極、カソードを陰極と呼びましたが、正極と陽極がまぎらわしいのでアノードと呼びます。 アノードは電流が外部回路から流れ込む極です。カソードは電流が外部回路へ流れ出す極です。 アノード、カソードは電流の向きに注目した呼び方です。 それとは別に正極と負極という呼び方があります。 電位の高い極を正極、電位の低い方を負極と呼びます。 正極、負極は電位の高低に注目した呼び方です。
リチウムイオン電池は、 正極集電体に正極合材、負極集電体に負極合材があって、それぞれ、 正極と 負極となります。 セパレータを介して電解液を挟みます。 活物質、導電助剤、バインダーなどを合材スラリーとして集電体上に、塗布し、乾燥して、電極とします。
正極では、 正極合剤は、 正極活物質、 導電助剤、 バインダー( PVdF、NMP)を混錬したスラリーからなり、 正極集電体に塗布・ 乾燥されている。 電池 の放電時は、 正極活物質にチウムイオンと電子が吸収され(電荷移動過程)、それぞれ導電助剤と電解液を通る。
電池材料負極では、 負極合剤は、 負極活物質、 導電助剤、バインダー(SBR、CMC、水)を混錬したスラリーからなり、 負極集電体 に塗布・乾燥されている。 電池 の放電時は、負極活物質からリチウムイオンと電子が放出され、それぞれ導電助剤と電解液を通る。
| 固体の分類 | 結晶 | 性質や特色 | 物質の例 | 用途 |
|---|---|---|---|---|
| 金属 | 金属( 導体 ) | ギャップ幅が狭い 金属光沢がある。 金属伝導 | 鉄、 🜠 銅、 🏞 亜鉛、 🜀 アルミニウム | 送電 |
| 半金属 | ギャップ幅が狭く、価電子帯の頂上と伝導帯の底がフェルミ準位を横切って いる | 黒鉛 *、ビスマス、アンチモン | ||
| 絶縁体 | 半導体(間接遷移型) | ギャップが比較的狭い | 🏞 ケイ素 ( 共有結合)、ゲルマニウム、炭化ケイ素 | パワーエレクトロニクス |
| 半導体(直接遷移型) | 同じ波数でのギャップが比較的狭い | ヒ化ガリウム | 発光ダイオード | |
| 絶縁体( 不導体 ) | ギャップが比較的広い | 酸化アルミニウム(イオン結合) ダイヤモンド(共有結合) | 碍子、電解コンデンサ |
電気を流すのは金属だけです。黒鉛が電気を流すのは例外です。
導体としては金属や合金が一般的であり、CuやAlなどの金属は送電用ケーブルに使用される。
最新工業化学―持続的社会に向けて―より引用
抵抗率は、 物性値です。 金属は、電流を流す用途で使うので、電気抵抗から損失を計算しやすいように抵抗率で表現し、 半導体や電解液は、キャリア濃度との関係から 導電率で表現することが多いです。
| 分類 | 状態 | 性質や特色 | 物質の例 |
|---|---|---|---|
| 気体 | プラズマ | 電離したイオンと電子が動く | 雷 |
| 液体 | 電解質溶液 | イオン結晶が、溶媒中で、電離し、 溶媒中を溶媒和したイオンが 泳動 | 食塩水, KOH aq, LiPF6/EC+DEC |
| 溶融塩、イオン液体 | イオンが泳動 | LiCO3+KCO3 | |
| 固体 | ゲル電解質 | 溶媒で膨潤したマトリクス中をイオンが 泳動 | PVdF? |
| 固体電解質 | 固定された格子中をカチオンが半融状態で 泳動 | AgI LiF(SEI) ポリマー電解質 |
電気分解は、電解質(電子絶縁体)の絶縁破壊です。
電気を運ぶものを キャリア (担体)と言います。 キャリア には、電子、ホール(正孔)、イオン、空孔(ベーカンシー)があります。
|
計測可能
な
物理量
(セル) |
界面
の特性値 (面積) |
バルクの
物性値
(セル定数) |
|---|---|---|
|
電気抵抗
R[Ω]
=電圧÷電流
,
|
反応抵抗(面積抵抗率)
Rct〔Ωm-2〕
=電圧÷ 表面 電流密度 接触抵抗 (界面抵抗) * =電圧÷表面電流密度 |
抵抗率(体積抵抗率)ρ
=電場強度e÷ 断面 電流密度 抵抗率ρ〔Ωm〕=電気抵抗R〔Ω〕÷ セル定数 a〔1/m〕 電気抵抗R=抵抗率ρ×長さl/面積S 14 ) 抵抗率ρ=1÷導電率 |
|
コンダクタンスG[S]
=1÷電気抵抗R |
導電率
σ(
|
|
|
静電容量
(キャパシタンス)C
,
|
電気二重層容量Cd〔Fm-2〕 |
誘電率
=電荷密度÷ 電場強度e |
|
インダクタンスL
,
|
透磁率 μ |
電池の内部抵抗は、 バルク抵抗だけでなく、界面抵抗に左右されます。 溶液に金属を浸しただけの ダニエル電池 のような単純な電池では、バルク抵抗が支配的ですが、 合材電極や固体電解質を使う リチウムイオン電池 のような複雑な電池では、界面抵抗が支配的です。 電池の内部抵抗の評価には、 交流評価と直流評価を組み合わせが必要です。
固体は、形状が決まっているので、接触界面に多様性がある。
| 固体 | 液体 | 気体(真空) | |
|---|---|---|---|
| 固体 |
面接触(例:
pn接合) 線接触(三相界面)(例:正極合材、 局部電池) 点接触(三相界面 ショットキー接触 )(例:固体電解質、 炭素導電助剤粒子 ) |
固液界面 (例:サスペンジョン) | 表面 |
| 液体 | 固液界面 (例:電極と電解液) | 液液界面 (例:エマルション) | 気液界面 ( 表面 ) |
| 気体(真空) | 表面 | 気液界面 ( 表面 ) | (混合) |
物質は、 様々な状態をとります。 界面や表面 は、ある材料の相と異なる材料の相が接するところです。
電池の内部抵抗は、バルクと界面との両方から生じます。
固体は、形状が決まっているので、接触界面に多様性がある。
接触抵抗 内部抵抗
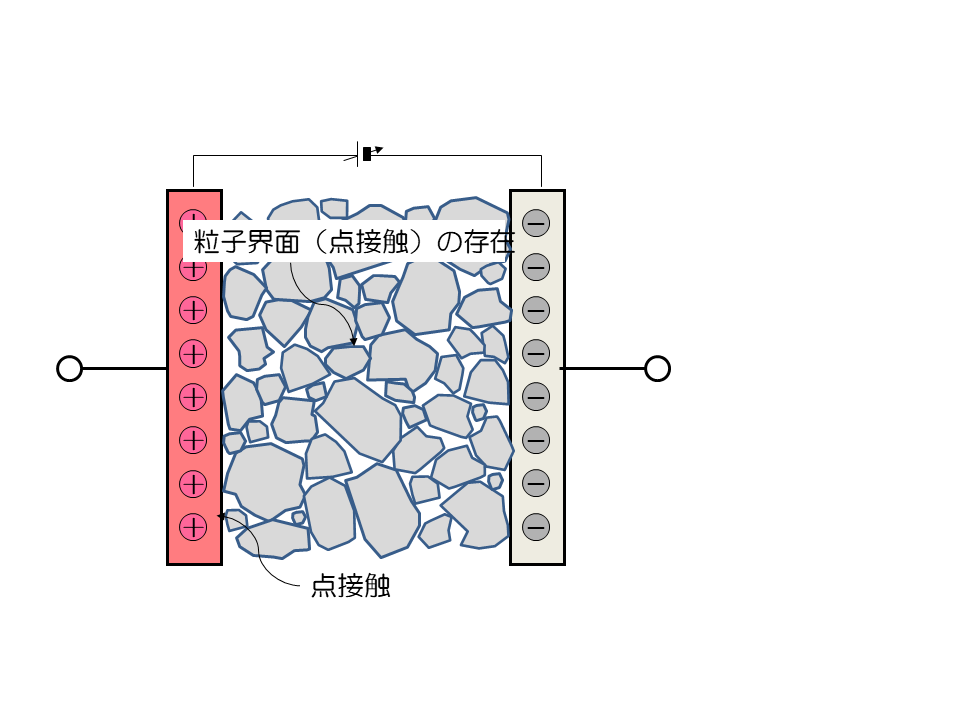
固体粒子の接触は、点接触です。面積を見積もるのがとても大変です。界面の電流密度がわかりません。 接触抵抗は電流集中( 集中抵抗)を伴うので、圧縮などの影響を受けやすいのです。活物質や炭素材料、固体電解質などの取り扱いが難しいのはそのためです。
| 化学結合の種類 | 結晶 | 性質や特色 | 物質の例 |
|---|---|---|---|
| イオン結合 | イオン結晶 | 固体 は 導電率が小さい(絶縁体)。水溶液や溶融塩は 導電率が大きい。 ( キャリア :イオン)。 | 塩化ナトリウム、塩化銀、水酸化ナトリウム |
| 共有結合 | 分子結晶 | 分子式 で表す。融点や沸点は低い。 | 酸素、アンモニア、水※1、ドライアイス |
| 共有結合の結晶 | フェルミ準位 はバレンスバンド中にあり、電子はそこに局在化している(共有電子)。 局在化した電子の負電荷と原子核の正電荷で結合している。 黒鉛や 導電性高分子は、π電子共役系の非局在化した電子により例外的に電気を通す。 | ダイヤモンド、 黒鉛、 🏞 ケイ素 水晶 、石英※2 | |
| 金属結合 | 金属の結晶 | 導電率 が大きい( キャリア : 自由電子)。 コンダクションバンド中にフェルミ準位があるので、電子が非局在化している。 | 銅、亜鉛、 🜀 アルミニウム リチウム |
※1.水分子は共有結合に分類されるが、液体の水はわずかに電離して電気を流す。 このイオン結合的な性質を、極性分子と表現する。
※2.ケイ酸塩のケイ酸はイオン結合に分類されるが、共有結合としての性質が強く、焼成などで成型することができる。


錆びにくい金属を貴金属と言います。 イオン化傾向は、金属と金属イオンの平衡反応の酸化還元電位に関係があります。 電位が卑なほど、 腐食しやすく、 還元しにくくなります。 電位が貴なほど、 腐食 しにくく、還元しやすいです。
| 界面 | 電位差 | 界面 | 例 |
|---|---|---|---|
| オーミックコンタクト | フェルミ準位が同じになるので、電位差は0 |
(固固界面)
金属|金属 |
銅|アルミニウム |
| 金属|半金属 | アルミニウム|グラファイト | ||
| 金属|半導体 | 白金|酸化チタン | ||
|
(固液界面)
金属| 電解液 |
白金|Fe2+,Fe3+/ aq | ||
| ショットキーコンタクト | 界面電位差 (起電力) |
(固液界面)
金属| 電解液 |
銅|銅イオン水溶液 |
|
(固固界面)
金属|半導体 |
ゲルマニウム|タングステン (接触ダイオード * ) | ||
| 半導体|半導体 | アルミニウム(酸化アルミニウム皮膜)|酸化マンガン(Ⅳ)、 | ||
| 金属| 固体電解質 | 金|ヨウ化銀 |
物質と 物質とが 接触すると、その 界面で電気的な相互作用が起こります。
固体同士の接触では、 点接触 になります。 しかし、製膜技術を使ってpn接合などを形成することもできます。

| 電流の流れ方 | 特徴 | ||
|---|---|---|---|
| 漏れ電流 | トンネル電流で、電流が漏れる | 圧力に敏感(炭素粉末など) | |
| 絶縁破壊 | ある電圧を超えると一気に電子が雪崩れ込む。 (活性化過電圧の存在) |
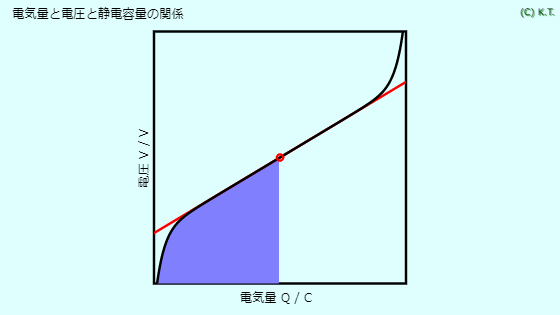
電池の容量は、活物質の量に支配されます。ファラデーの電気分解の法則から理論容量が計算できます。容量に電圧をかけると電池から取り出せるエネルギーが計算できます。質量や体積で割るとエネルギー密度となります。 電池の寸法は規格で決まっているので、電池の容量を増やすにはいかに活物質を詰め込むかにかかっています。
電池の発熱は、電流の二乗×内部抵抗。 発熱は、無駄な発電負荷であり、二酸化炭素の排出。 電池の内部抵抗を下げることが、脱炭素社会への道。
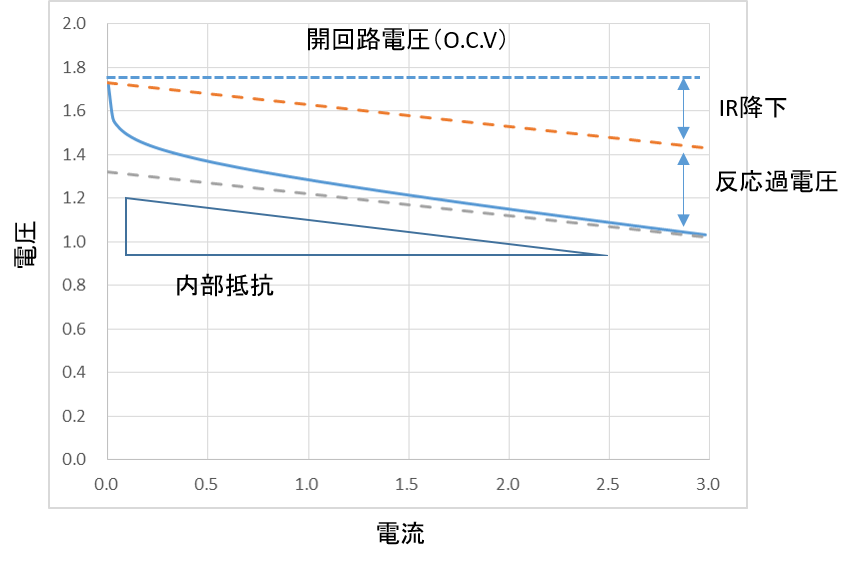
電圧降下=活性化過電圧+濃度過電圧+抵抗過電圧(溶液抵抗+接触抵抗)
電池の発熱は、電流の二乗×内部抵抗。 発熱は、無駄な発電負荷であり、無駄な二酸化炭素の排出。 大型電池ほど、放熱が不利になり、熱暴走のリスクが高まります 電池の内部抵抗を下げることが、脱炭素社会への道。
過電圧(電圧降下)=活性化過電圧+濃度過電圧+抵抗過電圧(溶液抵抗+接触抵抗)