構造からみたリチウム電池電極材料. 菅野了次, GS Yuasa Technical Report 2006 年 7 月 第 3 巻 第 1 号.
 🏠
🏠
 🏠
🏠
| 分類 | 材料 | 特徴 |
|---|---|---|
| 電極材料 | 正極材料 (活物質) | 極性固体、 酸化物、 イオン結合、 絶縁体 |
| 負極材料 (活物質) | 極性固体(金属やグラファイト)/非極性固体(酸化物) | |
| 導電材 | 非極性固体 炭素材料 | |
| 分散剤 | 界面活性剤 | |
| ◇ バインダー | 界面活性剤 | |
| CMC・増粘剤 | 極性材料 | |
| 集電体 (金属) | 非極性固体 | |
| 電解質 | 電解液、添加剤* | |
| セパレータ | ||
| その他 | 外包材・リードタブ |
界面は、 極性どうし、あるいは非極性どうし、だとなじみがいい。 異なる界面では、なじみが悪いので、界面活性剤などを検討する。
| 分類 | 原材料 | 製品 | ||
|---|---|---|---|---|
| セラミックス | クラシックセラミクックス | 土器 | 粘土 | 瓦・レンガ 甕 壺 |
| 🚂 陶器 | 陶石 | 食器 | ||
| 🚂 磁器 | 陶石 | 🚂 実験器具 | ||
| ニューセラミクックス | 🏞 アルミナ | |||
| ファインセラミクックス | 生体関連 | |||
| エネルギー関連 | シリコンカーバイド | |||
| 情報通信関連 | チタニア | |||
| 🏞 ガラス | ソーダガラス | ケイ酸塩 | 板ガラス・ガラス瓶・ガラス繊維 | |
| カリガラス | ケイ酸塩 | 実験用器具 | ||
| 鉛ガラス (クリスタルガラス) |
ケイ酸塩 | 装飾品 | ||
| ホウケイ酸ガラス (耐熱ガラス) |
ケイ酸塩 | 電球、ガラス器具 | ||
| セメント | ポルトランドセメント | 粘土・石灰石 | 土木・建築 | |
無機固体材料を製造するのを
酸化剤として使える固体は、酸化物が多い。必然的にセラミックスを使うことになる。 金属を使った電極は、充電時に形状を元に戻すことが極めて困難。
スラリーを使った成形抵抗率は、 物性値です。 金属は、電流を流す用途で使うので、電気抵抗から損失を計算しやすいように抵抗率で表現し、 半導体や電解液は、キャリア濃度との関係から 導電率で表現することが多いです。
電気が流れるのは電気を運ぶ何かが移動するからです。この電気を運ぶ何かをキャリア(担体)と言います。 キャリアには 電子と イオンがあります。金属は 電子伝導、 電解液はイオン伝導です。 欠陥がキャリアになることもあります。電子の欠陥はホール(正孔)であり、イオンの抜け穴はベーカンシー(空孔)です。
| 半導体の種類 | 結晶 | 性質や特色 | 物質の例 |
|---|---|---|---|
| n型半導体 | 酸素不足酸化物 | Ta2O5-x | |
| 金属過剰酸化物 | Mi X ⇄ Mi . + e ' | Ti1+yO2 | |
| p型半導体 | 金属不足酸化物 | Ni1-yO ,Co1-yO | |
| 酸素過剰酸化物 | Oi X ⇄ Oi ' + h . | UO2+x |
欠陥は、 クレーガー=ビンクの表記法で表されます 6 ) 。
| 化学結合の種類 | 結晶 | 性質や特色 | 物質の例 |
|---|---|---|---|
| イオン結合 | イオン結晶 | 固体 は 導電率が小さい(絶縁体)。水溶液や溶融塩は 導電率が大きい。 ( キャリア :イオン)。 | 塩化ナトリウム、塩化銀、水酸化ナトリウム |
| 共有結合 | 分子結晶 | 分子式 で表す。融点や沸点は低い。 | 酸素、アンモニア、水※1、ドライアイス |
| 共有結合の結晶 | フェルミ準位 はバレンスバンド中にあり、電子はそこに局在化している(共有電子)。 局在化した電子の負電荷と原子核の正電荷で結合している。 黒鉛や 導電性高分子は、π電子共役系の非局在化した電子により例外的に電気を通す。 | ダイヤモンド、 黒鉛、 🏞 ケイ素 水晶 、石英※2 | |
| 金属結合 | 金属の結晶 | 導電率 が大きい( キャリア : 自由電子)。 コンダクションバンド中にフェルミ準位があるので、電子が非局在化している。 | 銅、亜鉛、 🜀 アルミニウム リチウム |
※1.水分子は共有結合に分類されるが、液体の水はわずかに電離して電気を流す。 このイオン結合的な性質を、極性分子と表現する。
※2.ケイ酸塩のケイ酸はイオン結合に分類されるが、共有結合としての性質が強く、焼成などで成型することができる。
誘電率は、簡単に言えば電荷密度と電場強度金属の比です。
金属は、 金属結合 なので、分極されると、電荷が表面に集まります。このような分極を静電誘導と言います。
活物質は、 イオン結合 なので、分極されると、イオンの位置がずれて電気がたまります。このような分極を誘電分極と言います。

銅 やアルミニウムの金属は、 抵抗率が小さく、 電線や集電体に使われます。
金属は、金属結合しています。 全体に広がった波動関数のエネルギー準位がある導電帯にフェルミ準位があり、電子がバルク全体に非局在化しているからです。

金属酸化物などのイオン結晶は、イオン結合しています。 全体に広がった波動関数のエネルギー準位がある価電子帯にフェルミ準位があり、電子が原子の近傍に局在化しているからです。 電子が局在化して、バルク全体で移動できないという点で、共有結合結晶や分子結晶でも同じです。
グラファイトなどの 炭素材料やポリチオフェンなどの導電性高分子材料では、電子が非局在化できる状態にあり、導電性を示します。
電池には電極があります。
酸化が起きる極をアノード、還元が起きる極をカソードと呼びます。 以前はアノードを陽極、カソードを陰極と呼びましたが、正極と陽極がまぎらわしいのでアノードと呼びます。 アノードは電流が外部回路から流れ込む極です。カソードは電流が外部回路へ流れ出す極です。 アノード、カソードは電流の向きに注目した呼び方です。 それとは別に正極と負極という呼び方があります。 電位の高い極を正極、電位の低い方を負極と呼びます。 正極、負極は電位の高低に注目した呼び方です。
ダニエル電池を放電するときは、負極の亜鉛が酸化して亜鉛イオンになります。 つまり負極がアノードです。 乾電池の負極も亜鉛です。 乾電池に豆電球をつないで点灯させているときも亜鉛が亜鉛イオンとなって溶け出していることになります。
| 例 |
ヘルマン・モーガン記号 (Hermann-Mauguin) |
シェーンフリース記号 (Schoenflies) |
説明 | |
|---|---|---|---|---|
| H2O | C2v | |||
| CH4 | Td | |||
| LiCoO2 | 便宜的に 六方晶系 |
集合に定められた演算について、結合律が成り立つとき、その集合は半群です。 さらに交換律が成り立つとき、その集合は可換半群です。 単位元をもつ半群のすべての元が逆元を持つとき、その半群は群といいます 7 ) 。
物質の誘電率について 出典:山本電機工業
正極合材は、正極活物質、導電助材、結着材を正極集電体に塗布乾燥して正極とする。
コバルト酸リチウム、マンガン酸リチウム、リン鉄酸リチウムリン酸鉄リチウム1)、EMD二酸化マンガン(IC21)、ニッケル酸リチウム、酸化銀、酸化銅など。
リチウムイオン二次電池の活物質は、数ミクロンから数10ミクロンの粒径を持つものが実用化に適している。粒径が大きいとリチウムイオンの拡散が間に合わなくなり、粒径が小さいと比表面積が大きくなって導電助材やバインダーの量が増えて、電池容量が小さくなってしまうからである。
| 活物質/ 略号 | 理論容量 /mAh/g | 実効容量 (可逆容量) /mAh/g | 用途 | 特徴 |
|---|---|---|---|---|
| 酸素 | 燃料電池、ガルバノ電池(ボルタ電堆)、 11円電池 | 気体 | ||
| 銅イオン | ダニエル電池 | 液体 | ||
| 二酸化マンガン | 308.3 | アルカリ乾電池 | ||
| 🏞 コバルト酸リチウム/ LCO | 273.8 | 130~150 | リチウムイオン電池 (スマホ) |
LiCoO2←Li++e-+CoO2
コバルト回収採算可 |
| 🏞 ニッケル酸リチウム | 274.5 | |||
| NCM | 277.9 | 160 | ||
| リチウム過剰NCM | 267.1 | 160 | ||
| ハイニッケル NCM,LNCM523 | 180~200 | ニッケル回収採算可。 インセンティブは補助金? | ||
| 🏞 ハイニッケルNCA | 180~200 | ニッケル回収採算可 | LiNi0.8Co0.15Al0.05O2←0.95Li++0.95e-+Li0.05Ni0.8Co0.15Al0.05O2 | |
| 🏞 マンガン酸リチウム(スピネル) LMO * | 148.2 | 110~120 | 密度4.1 * 導電率1×10-6S/cm | |
| 🏞 LFP LiFePO4 | リーズナブル。 バイポーラで、NCM置換可能。 |
正極活物質は、主に 電池 の 正極で使われる酸化剤です。 充電式電池(二次電池)では、充電前の電池材料 である正極材料も活物質と呼ばれることがあります。 負極には還元剤が使われます。 酸素、酸化物(二酸マンガン)やフッ化物、硫化物が使われます * 。
* F=96485.33212331 F/Fw*Z正極活物質の反応は、 大きく均一固相反応と二相反応に分類されます。 MnO2やLCOは、均一固相反応と言えます。NiOOHやLFOは二相反応と言えます。 均一固相反応の放電曲線はS字型を描き、二相反応の放電曲線はL字型を描きます。 放電深さにおける起電力はネルンストの式で議論でいます。 バッテリーマネジメント の立場から言うと、S字型の放電曲線は、電圧だけで 残量管理ができるメリットがあります。 しかし負荷からすれば電池の電圧が変動してしまうデメリットもあります。
電池活物質が100%反応したときの電気量を理論容量と言います。
理論容量 :電池活物質が100%反応したときの電気量これはファラデー定数を式量で割れば求めることができます。 慣例的に電池の電気量は、〔mAh〕で表現されます。 ファラデー定数は、慣例的に〔C/mol〕で表現されますが、 ここでは、〔mAh/mol〕で表現した方が、計算に便利です。
96485.332 〔 C/mol 〕 は、アボガドロ数×電気素量で、それらはSIで定められた 定義定数 です。
工業的には、 26.801 〔 Ah/mol 〕をよく使います。
ファラデー定数は、 エネルギー密度や理論容量の計算にも使います。
でも二酸化マンガンは、MnO2-xのように 非量論化合物なので、厳密に式量は定義できない。 電池で使う活物質は、非量論化合物が多い。
電池活物質の式量Fw/g/molリチウムイオン電池の 12 ) の正極として使われる コバルト酸リチウムの式量は、97.873である。 よって、理論容量は、273.9mAh/gとなる。 でもコバルト酸リチウムは、厳密には、酸化してはじめて正極活物質となる。 その場合式量としてリチウムが抜けた状態の量を使って282.6mAh/gとなる。 実際には100%リチウムを抜くことはできない。 そこで慣例的に、コバルト酸リチウムを正極活物質として計算することが多いようである。*
| 式 | 説明 |
|---|---|
|
電気エネルギー Eは、電気量Qの関数であるところの作動電圧Voを電気量で積分して得る。 理想的な電池では、電気量Q=電池容量× SOCである。 電気量Qは、電池では容量とも言われる。静電容量〔F〕と 電池容量〔Ah〕は単位が違うので注意。 電池の理論容量は、活物質の物質量に比例する(ファラデーの電気分解の法則)。 |
|
| 作動電圧(Q)は、電池の起電力(Q)から電流の関数であるところの過電圧を差し引いて得る。 | |
| 電流と電気量の関係を使って、全て電気量で記述できる。 | |
| 過電圧が、 電池の内部抵抗だけで近似できるなら、 | |
|
作動電圧(Q)=
電池の起電力(Q)±過電圧(I) 電流は電気量の時間微分なので、 作動電圧(Q)=電池の起電力(Q)±過電圧(dQ/dt) |
電池の単位重量当たりの電気エネルギーを重量エネルギー密度、 電池の単位体積当たりの電気エネルギーを体積エネルギー密度と言います。
| 量名 | 記号 | 単位 | 式 | |
|---|---|---|---|---|
| 密度 | ρ | kg/m3 | ||
| 比表面積形状係数 | φ | φ=6(球、立方体、直径と高さが等しい円柱) | ||
| 直径 | d | m | d=2×半径(球) | |
| 比表面積 | S | m2/kg | S=φ÷ρ×(1/d) | |
| 比表面積 | S | m2/kg | S=φ÷ρ×∫1/d(w)*dw |
単位質量の 粉体 の全表面積を、 粉体 の比表面積と言います。 一定量の固体を 粉砕すると、 その表面積は粒径にほぼ反比例して増加します 14 ) 。
Rb+Ri+Rpは、15kΩ以下と推定された。 等価回路
©2020 K.Tachibana| 界面 | 電位差 | 界面 | 例 |
|---|---|---|---|
| オーミックコンタクト | フェルミ準位が同じになるので、電位差は0 |
(固固界面)
金属|金属 |
銅|アルミニウム |
| 金属|半金属 | アルミニウム|グラファイト | ||
| 金属|半導体 | 白金|酸化チタン | ||
|
(固液界面)
金属| 電解液 |
白金|Fe2+,Fe3+/ aq | ||
| ショットキーコンタクト | 界面電位差 (起電力) |
(固液界面)
金属| 電解液 |
銅|銅イオン水溶液 |
|
(固固界面)
金属|半導体 |
ゲルマニウム|タングステン (接触ダイオード * ) | ||
| 半導体|半導体 | アルミニウム(酸化アルミニウム皮膜)|酸化マンガン(Ⅳ)、 | ||
| 金属| 固体電解質 | 金|ヨウ化銀 |
物質と 物質とが 接触すると、その 界面で電気的な相互作用が起こります。
固体同士の接触では、 点接触 になります。 しかし、製膜技術を使ってpn接合などを形成することもできます。
ハードカーボン、ソフトカーボン、ダイヤモンド、DLC、活性炭、人造グラファイト(黒鉛)、炭素繊維、カーボンナノチューブ(CNT) 籾殻燻炭
炭素材料は、 導電性があるので、 電池 の導電助剤として使われます。
電池の内部抵抗は、過渡応答や 交流インピーダンス法で、評価されます。
| 分類 | 細目 | 説明 | ||
|---|---|---|---|---|
| 天然炭素材料 | 石炭 15 ) | |||
| 天然黒鉛 (グラファイト、石墨 16 ) ) | 鉛筆、 リチウムイオン二次電池( 負極) | |||
| 合成炭素材料 | 木炭 | たたら製鉄 | ||
| 人造黒鉛 17 ) | ピッチ を加熱して合成します。 | |||
| 活性炭 | ||||
| オイルファーネスブラック | ||||
| 気相合成炭素 | アセチレンブラック | 🧬 | ||
| カーボンクラスター | フラーレン | |||
| カーボンナノチューブ(CNT) | ||||
| カーボンナノホーン(CNH) |
黒鉛は、ダイヤモンド、無定形炭素とともに炭素の同素体である 18 ) 。 無定形炭素は、燃えるが、黒鉛は、燃えない。 だから、製鉄の高炉用炉材として使う。 化学的に安定で、耐熱性もあり、潤滑性もあるので、鉄砲の内張にも使われた。
黒鉛は、面内で高い 導電率を示す。 アルミニウム溶融塩電解の アノード、 食塩電解の アノードに使われます。
鉄の 融点 Tm はおよそ 1538 °C 。 とても容器が持たない。 だからコークスと混ぜて高炉に入れる。
👨🏫 石炭と炭素材料アセチレンブラックは、リチウムイオン電池の正極導電助剤としてよく使われます。粒径が小さく、充填効率が良いのでエネルギー密度の向上が期待されるからです。ABの導電機構は、基本的にはグラファイトと同じです。六角網面が球状に重なったオニオン構造をとり、それがクラスターを作り、ABの一次粒子となっています。
カーボン材料の表面はほとんど水素です。 官能基は、解放型とラクトン型に分類されます。 官能基の分析は、熱分析などによりますが、精度を上げることは困難です 21 ) 。
🏞アセチレンブラック
炭素粒子の表面は、炭素ではありません。 むしろほとんど水素と言った方がいいでしょう 22 ) 。
グラファイトを構成するグラフェン面(六角網面)は、無限に大きい平面というわけではありません。 端面(エッジ面)は、水素、水酸基、酸素などで終端されていると考えられます 23 ) 。
グラファイト でもCNTでも六角網面では、 半金属ないし半導体の伝導性がありますが、 炭素粒子の 接合界面では、 ホッピング伝導か ツェナー降伏 * となっている可能性があります。
炭素(黒鉛、石墨、グラファイト)は、 半金属です。 伝導帯と価電子帯のバンドキャップが0です。 フェルミ準位がそこにあります。 それで、熱で生成した電子とホールが、ある波数で非局在化して電気伝導に預かります。
しかしグラファイトのエッジ面は、水素などで終端されています。 炭素粒子と炭素粒子が接触し、接合するエッジ面では、電子は局在化していると考えられます。 ここでは、バンドギャップが存在します。伝導帯の最下部であるLUMOは、 フェルミ準位の上となり、電子が少なく、空乏層となっていると考えられます。
しかしながら、エッジ面とエッジ面が十分に近接すれば、 ツェナー降伏によるトンネル電流が流れると考えられます。 エッジ面とエッジ面との距離が近づくと、トンネル電流は指数的に大きくなるため、 炭素粉末の粉末抵抗は、圧力に対して指数的に小さくなります。 リチウムイオン二次電池などで、電極をプレスするのは、ひとつにはそのためです。
* *負極活物質としての炭素材料は炭素への層間化合物として使われます。 グラファイト系の炭素材料です。 ソフトカーボン、 ハードカーボン
炭素材料の表面は炭素ではありません。 表面の極性は電池性能に大きく影響を及ぼします 24 ) 。
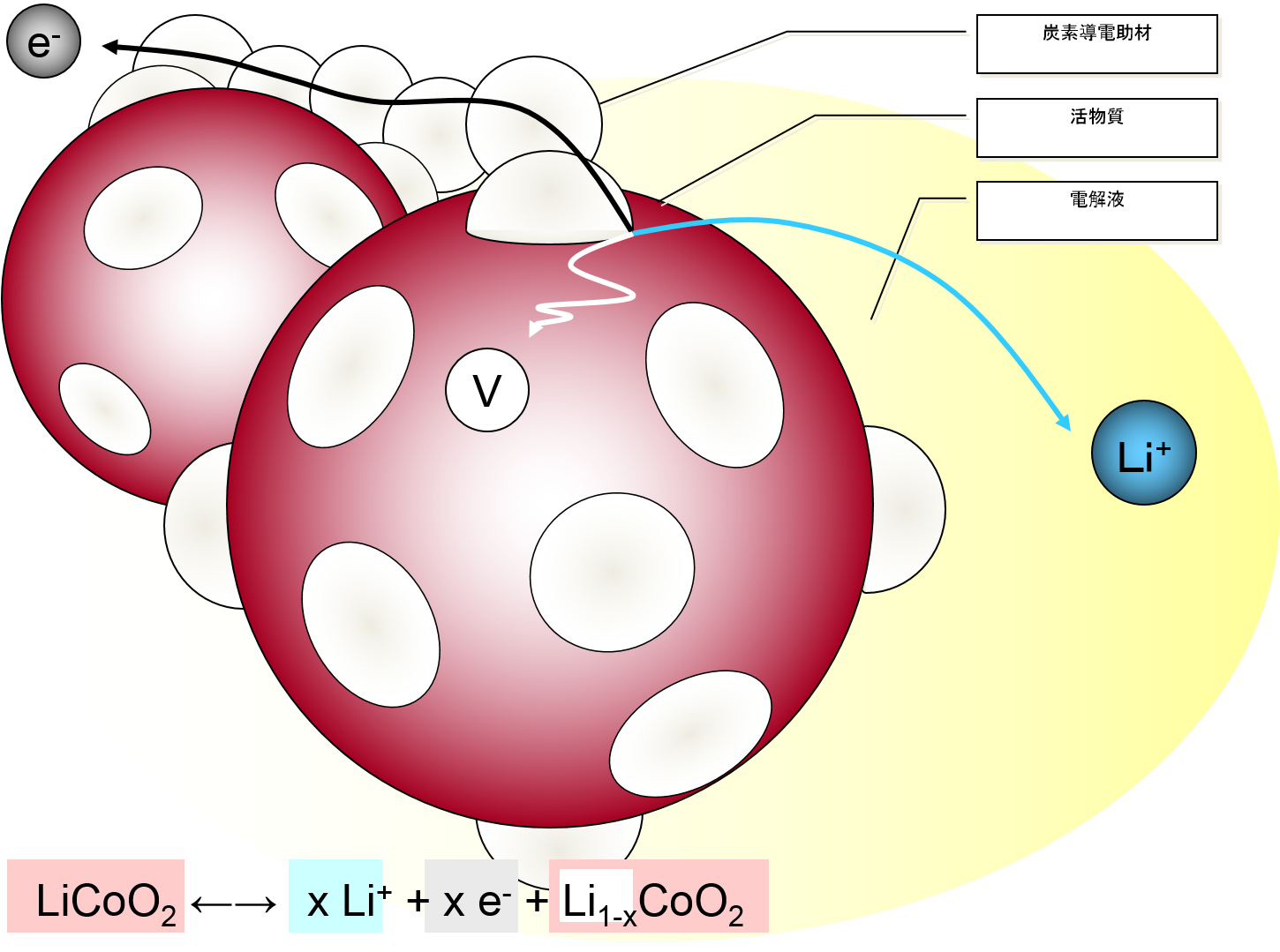
合材電極内部の活物質表面には、導電助剤、電解液、活物質の三相界面がある。 充電時には、電子が電子パスの導電助剤へ、リチウムイオンがイオンパスの電解液へ、そして空孔(ベーカンシー)が活物質バルクへと移動する。
構造からみたリチウム電池電極材料. 菅野了次, GS Yuasa Technical Report 2006 年 7 月 第 3 巻 第 1 号.
「椅子を高く持ち上げたときに消費するエネルギーは、椅子の位置エネルギーに時間をかけて求めることができる」はほんとうか?? 問
銅の電解精錬に使う電力は何のためか?それを節電するにはどうしたらいいか?注意すべき点は何か?? 問
