 🏠
🏠
 🏠
🏠
電気が流れるのは電気を運ぶ何かが移動するからです。この電気を運ぶ何かをキャリア(担体)と言います。 キャリアには 電子と イオンがあります。金属は 電子伝導、 電解液はイオン伝導です。 欠陥がキャリアになることもあります。電子の欠陥はホール(正孔)であり、イオンの抜け穴はベーカンシー(空孔)です。
| 化学種 | 式 | 式の種類 | 例 |
|---|---|---|---|
| 水素 | 元素記号 | H | |
| 水 | 分子式 | H2O | |
| 水 | 電子式 | H:O:H | |
| 水 | 示成式 | H-O-H | |
| 水 | 構造式 | H-O-H | |
| 水素分子 | 分子式(化学式) | H2 | |
| 硫酸アルミニウム | 組成式(化学式) | 3Al2(SO4)3 | |
| 炭酸イオン | イオン式(化学式) | CO32- | |
| アルミン酸イオン | イオン式(化学式) | [Al(OH)4]- | |
| 蛍光体 | 賦活 | (Cr,Ca,Ba,Mg)5(PO4)3Cl:Eu3+ | |
| クレーガー=ビンクの表記法 | ショットキー欠陥 | null⇔2VAl'''+3VO・・ | |
| クレーガー=ビンクの表記法 | フレンケル欠陥 | OO×⇄Oi''+VO・・ | |
| ダニエル電池 | 電池式 | Zn | Zn2+ || Cu2+ | Cu |
化学式には、組成式、構造式、示性式、電子式などがあります。 欠陥 には、クレーガー=ビンクの表記法が使われます。 デジタル情報としては、 SMILES記法などがあります。 また伝統的なファイル形式として、mol形式などがあります。 XML形式としては、CML形式などがあります。
| 形態 | 説明 | 流動 | |
|---|---|---|---|
| 対流 | 重力・動力(撹拌) | ポンプによる 輸送や 気温による上昇気流。 | |
| 🖱 泳動 | 電位勾配/ クーロン力/導電率 抵抗過電圧 | 位置エネルギーを最小に | 慣性支配 |
| 🖱 拡散 | 濃度勾配/拡散係数 | エントロピーを最大に 拡散方程式 拡散過電圧 | 粘性支配 |
拡散と対流は、イオン移動だけでなく物質移動でも起こります。拡散はイオン移動だけでなく 熱移動でも起こります。
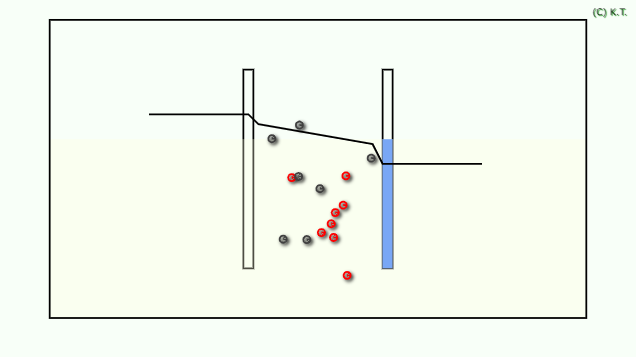
導電率は、 物性値です。 ベクトル量なので、導電異方性があれば、方向依存性があります。
導電率は、電流密度を電界の強さの比です。 電界の強さは電位勾配であり、電位勾配を見るには位置に対して電位を示した電位プロファイルが便利です。
| 材料 | 導電率 / S/m | 抵抗率 / Ω・m | |
|---|---|---|---|
| 1M KCl aq | 11.00 | 0.09 | |
| 0.1M NaOH aq 3 ) | 2.20 | 0.45 | |
| 1M LiPF6/PC+DME(1:1mol) 4 ) | 1.59 | 0.63 | |
| 35wt%食塩水( 🏞 海水) 5 ) | 4.00 | 0.25 | |
| 水道水 6 ) | 0.01 | 100.00 |
電解液( 電解質) はイオン電導です。自由電子による 金属の電子伝導に較べて導電率は8桁ほど小さくなります。 電池の内部抵抗を減らすには、 電極面積を増やし、電極間距離を縮め、導電率の高い電解液を使います。
導電率は 物性値なので、材料の形状によりません。 かたや形状のない材料などありません。
◇ 1950年代、石油化学工業が発達しました。 そして1958年、有機電解液が発明されました。
高校で習った通り、極性物質は極性溶媒によく溶けて、非極性物質は非極性溶媒によく溶けます。 電池の電解液は電子を通さず、電気を流す都合、イオンが溶けていることが求められます。 よって極性物質の代表格である塩が溶けていなくてはなりません。 したがって、溶媒は極性溶媒ということになります。 しかしながら、リチウムは水と反応しますから、有機溶媒でなくてはなりません。 しかも、水というよりプロトンと反応しますから、非プロトン性溶媒でなくてはなりません。 極性をもって非プロトン性となると、やはりエステルですよね。 高校で習った通り、エステルはフルーツの香りがします。 だからリチウム電池の電解液はフルーツの香りがするのです。
電解液の導電率が大きいほど、 電池の内部抵抗 は下がる。 導電率は電離した電解質の濃度と電解液の粘度に支配される。 イオン半径の大きなアニオンは電離しやすい。 誘電率の大きな溶媒は電解質をよく溶かす。 濃度が大きく、誘電率の大きな電解液は粘度も増すので、電解液はそれらのトレードオフとなる。
リチウムイオン二次電池には、非水溶媒からなる有機電解液が使われている。非水溶媒は、水より誘電率が低い。よって非水溶媒は、水より塩を溶解しにくい。ゆえに、有機電解液は、水溶液電解液と較べて導電率が小さい。
電解液。 電解液の中の電気の担い手はイオンと呼ばれる荷電粒子だ。 イオンの重さは一番軽い水素イオンでも電子の重さの1800倍。 この重さの違いはゾウとモルモットの体重差に匹敵する。 だから、電池から電流を取り出せているとき、電気の重たさは気にせずともよい。 電気の動く向きを変えようとしたときに、電気の重たさからくるリアクタンスをインダクタンスと言い、 電気のたまりからくるリアクタンスをキャパシタンスと言う。 電池から電流を取り出せているときは、電気の重たさは気にせずともよいのだから、リアクタンスはキャパシタンスだけで表現すればよい。 すなわちX=1/wC。
「椅子を高く持ち上げたときに消費するエネルギーは、椅子の位置エネルギーに時間をかけて求めることができる」はほんとうか?? 問
銅の電解精錬に使う電力は何のためか?それを節電するにはどうしたらいいか?注意すべき点は何か?? 問
