 🏠
🏠
 🏠
🏠
 電流・電位・電気量の測定とファラデーの法則
電流・電位・電気量の測定とファラデーの法則
化学実験Ⅰのエネルギー化学分野は、2024年度より 化学実験Ⅱとして開講されます。
| 用語 | 定義 | 備考 |
|---|---|---|
|
|
||
|
|
反復測定において、予測が不可能な変化をする測定誤差の成分 | |
|
|
反復測定において、一定のままであるかまたは予測可能な変化をする測定誤差の成分 | |
|
|
測定値がそろっていあいこと。また、ふぞろいの程度。 | 偶然誤差とほぼ同義。 |
|
|
測定値の期待値と真値の差 | 系統誤差とほぼ同義。 |
|
|
測定値に付随する、合理的に測定対象量にむすびづけられる値の広がりを特徴づけるパラメータ | 知識の曖昧さも含む |
|
|
同一の測定対象量に対する測定を複数回行うこと | 測定条件が同一かどうかによらない。 実験計画法では、ブロック単位での実験を指す。 |
|
|
同一の測定対象量に対する測定手順、オペレータ、操作条件、場所が同一の、短期間での測定の反復 | 操作条件は、因子。繰り返し数は、標本数に相当する。 |
|
|
測定の再現条件下での測定の精密さ | |
|
|
精度。 ばらつきの小ささを表す。 | |
|
|
確度 | |
| 測定値 | 規定された測定手順に実施によって得られる 量の 値 | 測定を反復するときは、個々の値、もしくは代表値(平均値や中央値など)のいずれも測定値と呼ぶ。 |
| 指示値 | 測定器が提示する 量の 値 |
硫酸銅水溶液に浸したゼムクリップに電気を流して銅を析出させめっきします。流す電気の量と析出した銅の重量が ファラデーの電気分解の法則 に従っていたら、3mgの銅を定量的にめっきできるかどうか試みます。
電気量を測る装置を電量計またはクーロメーター(coulometer)とよぶ。またこれをボルタメーター(voltameter)とよぶことがあるが、この名はボルトメーター(voltmeter)と紛らわしくてよくない。何クーロンの電気が流れたかを測る器であるから、クーロメーターとよぶ方が適当である。
クーロメーターは、測ろうと思う電流を電解質水溶液に通じて電気分解を行わせ、析出した金属または気体の量を測り、ファラデーの法則を用いて、そのとき通じた電気の量を知る装置である。
鮫島実三郎. 物理化学実験法 より 3 )
消火器、非常用シャワーなどに異常がないか実験室の安全を確認したら、手を洗いましょう。実験ノートに日付と室温、天候などを記入し、実験の準備に取りかかります。試薬類はグループ毎の汚損および過剰使用を避けるため、実験台ごとに小分けしてありますが、もとの瓶のラベルを見て、試薬名、化学式、毒性、危険性などについて確認しましょう。
使用する前に,乾電池の電圧を確認すること。電池の消耗は常に注意し、節電を心がける。万一、みの虫コードなどの半田が取れたりした場合は、自分で補修する。

物質量n〔mol〕と 電気量n〔C〕 は比例します。これを ファラデーの電気分解の法則と言います。 比例定数はファラデー定数F=96485.3415〔C/mol〕です。
ファラデーの法則を使って電気量を測る装置を クーロメーターと言います 6 ) 。 銀クーロメーター 7 ) 、 1936年の レイリー型電流天秤 8 ) を経て、現在の電気基準になりました。 産業界では、実用上、ツェナダイオード電圧標準器と標準抵抗器を標準としています。
先生:「実験は安全第一、実験台の上を整理整頓して服装を整え、手を洗ったら実験開始だ」
学生:「了解!」
先生:「学生実験の人数は,何人くらいかな?」
学生:「40人くらいです」
先生:「硫酸銅の秤取りは,一人3分ぐらいかかります.40人だと最後の人が量り取りが完了するまで,120分かかるよ.」
先生:「硫酸銅の秤取りが終わらなくても,めっき前のゼムクリップの秤量ができるので,空いている方からやってください.」
学生:「了解! 硫酸銅の秤取りとゼムクリップの秤量の空いている方からやって早く実験をします.」
先生:「まずは電極を作らないとね、環境にやさしくできるだけスモールスケールで」
学生:「このクリップを電極にするんですね」
先生:「前処理すると精度が高いけど、時間がないから省略!電解前後の重量差を調べるからしっかり秤量して」
学生:「了解!」
先生:「電流密度を見積もるために電極面積を測っておこう!」
学生:「どうやるんですか?」
先生:「なあに、簡単。ノギスでゼムクリップの寸法を測ればいいのさ」
学生:「なるほど!」
先生:「バーニヤまで読んでね!」
学生:「了解!」
先生:「ビーカーの寸法も測っておけば、浸漬深さがわかるね!」
学生:「そこから円筒の表面積を求めるってわけですね」
先生:「円周率は3.14で十分な精度だ」
学生:「面積でました0.6平方センチメートルです!」
先生:「次に電解液。硫酸銅水溶液を作ろう」
学生:「わー、真っ青」
先生:「硫酸やアルコールを加えて脱気するとなおベターだけど、時間がないから省略!
次はセルの組み立てだ。倒れないよう実験台にしっかり固定しよう」
学生:「できました」
先生:「そうしたら通電!電流密度は0.02アンペア毎平方センチぐらいにしようか
電流密度が大きすぎるとガス発生などの副反応が起きて精度が下がるから注意しよう」
学生:「さっき測定し電極面積の出番が来ましたね」
先生:「そのとおり」
学生:「通電電流は0.012アンペアです」
先生:「ではスライド抵抗器を操作して目標電流になるよう分極するよ」
学生:「了解!」
先生:「ストップウォッチを作動させるのを忘れずに、よーいどん!!!」
続き…詳細なテキスト

電卓で秤取る硫酸銅・5水和物の重さを計算し,時計皿と使って秤とる.ビーカーに硫酸銅・5水和物を移し,洗瓶で薬さじ・時計皿を洗い流す. ビーカーの目盛で3mLまで水を加え,0.5 Mの硫酸銅水溶液完成!,廃液ゼロ,溶液調整ミッションコンプリート👍

メッキ前のクリップの質量を,精密電子天秤で秤量する.秤びんは,数が限られているので,乾燥の時間が足りなくなる場合あるので,その場合は,10mLビーカーで代用してよい.

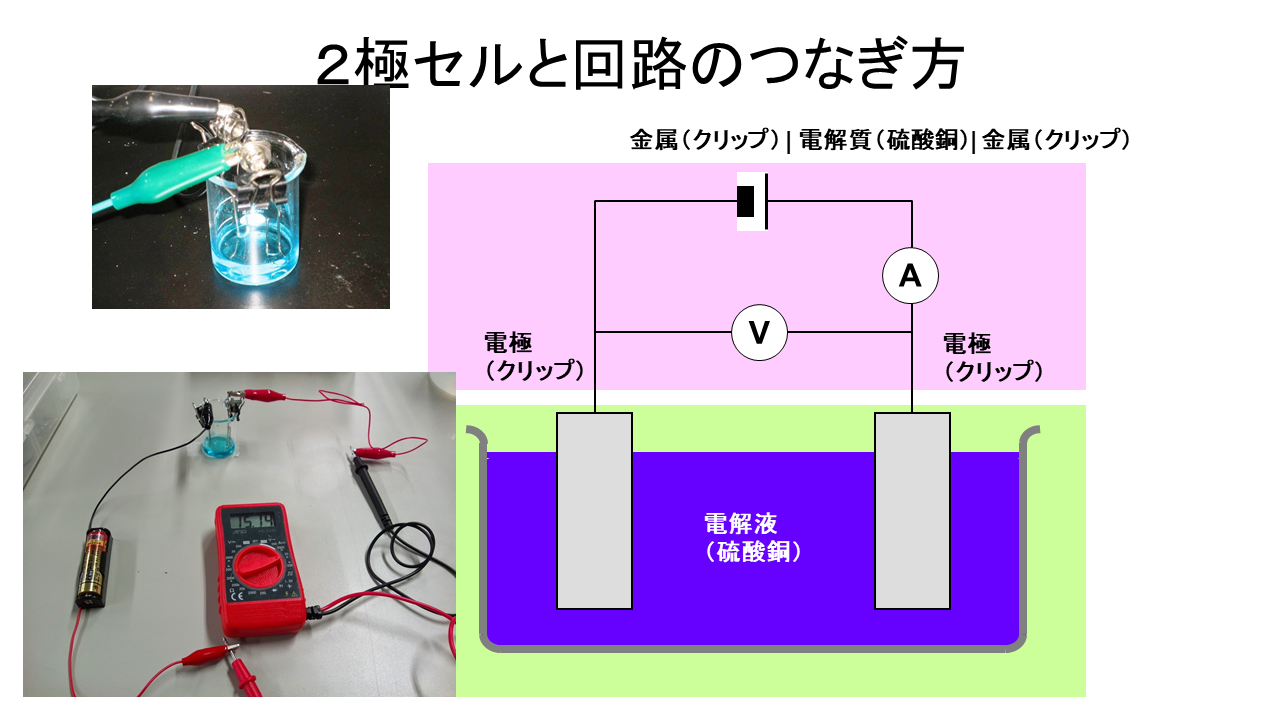
電気化学セルを組み立てましょう。

| 電池系/電解系 | 電池式 | 備考 | |
|---|---|---|---|
| ダニエル電池 | Zn | Zn2+ || Cu2+ | Cu | ||
| リチウムイオン二次電池 | Cu|C6Li|LiPF6 EC+DEC|□CoO2,C|Al | ||
|
銅の電解精錬 /銅めっき / 銅クーロメーター |
Cu|CuSO4aq|Cu | ||
|
アルミニウムの アノード酸化 |
Al| Al2O3 | NH4OOC(CH2)4COONH4 aq | ||
| 銀のアノード酸化 | Ag|AgCl|HCl aq |
電池式では、 界面を縦棒(|)で表します。
作ったセルに電気を流すための同線を繋いで、回路を作ろうね。まだ、電気は流さないね。電気を流した瞬間でメッキされますよ。ストップウォッチを準備して、
電析させてクリップに銅をメッキしよう。 電析シミュレータを使ってもわかる通り、時間が経過すると銅のメッキの量が増えるぞ。
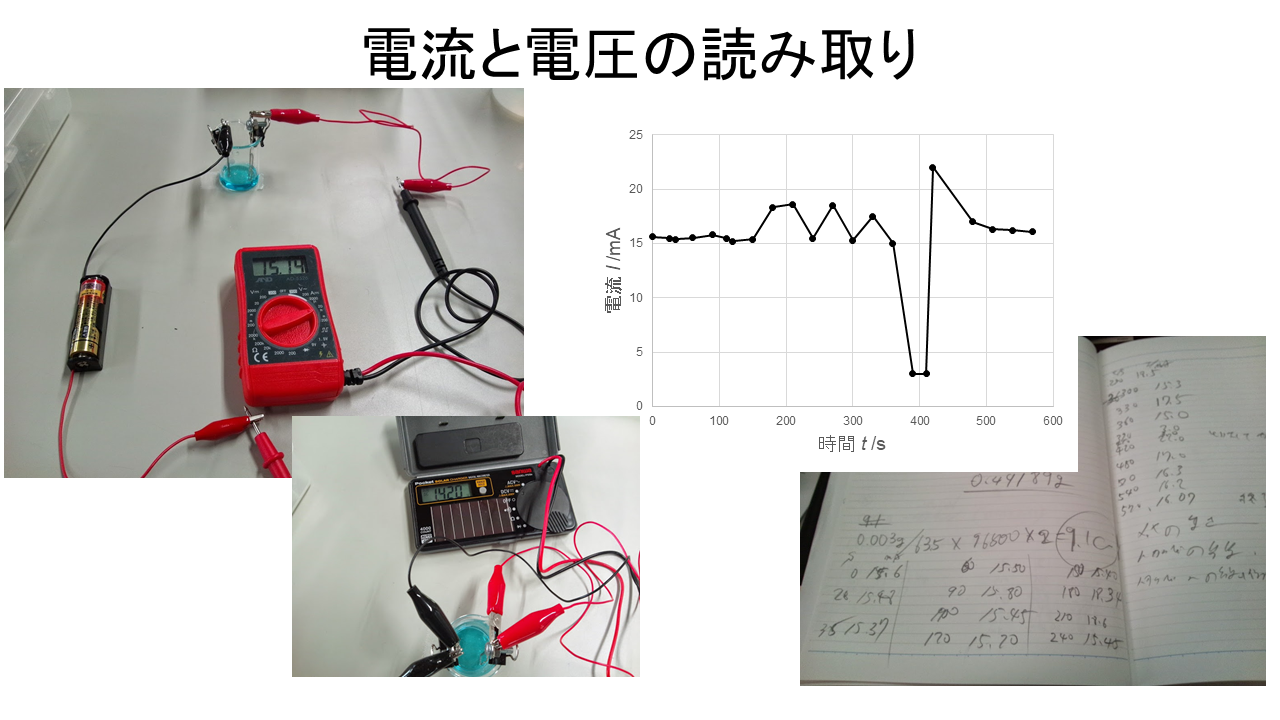
メッキ後のクリップの重さを精密電子天秤で秤り、さて、何グラムの銅がメッキされたかなぁ。わくわく、電気量との関係はどうかなぁ。


 【演習】10-02 電流・電位・電気量の測定とファラデーの法則の実験手順書の作成と電気量の計算
【演習】10-02 電流・電位・電気量の測定とファラデーの法則の実験手順書の作成と電気量の計算
問1.化学実験I 10回目(エネルギー化学実験1回目)電流・電位・電気量の測定とファラデーの法則の実験手順を自分が実際に実験をするときの手順をイメージして、実験手順書を作成し、ウェブクラスに記述してください。
問2.電流・電位・電気量の測定とファラデーの法則のクリップに銅をメッキする実験について,メートルブリッジを組み立て,電圧を制御する操作の実験手順書を,自分が実際に実験をするときの手順をイメージして,記述してください.

問3.下記の実験データから,電気量を計算して,その計算過程と計算結果をウェブクラスに記述してください.
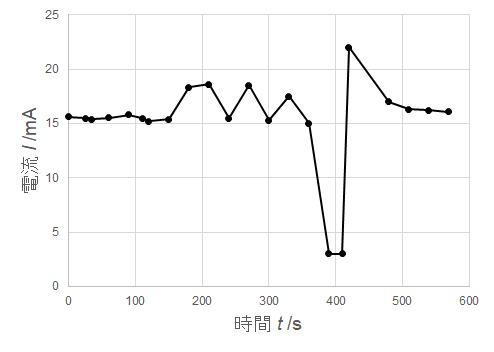
クリップにメッキされた銅の重さは2.9mgであった.問3の計算結果を用いて,電流効率を計算し,計算過程と計算結果を単位を含めて回答しなさい.
テキストの配点表(進捗票)を元に,電流・電位・電気量の測定とファラデーの法則の実験の自己評点を集計して,ウェブクラスの「電流・電位・電気量の測定とファラデーの法則の実験評点集計」に提出してください。 自主的に取り組んだ配点表にない項目でアピールできること(失敗談,安全への配慮,テキストの改善案,ヒヤリハット報告)なども実験ノートに記述してください. アピールできることについて、ご近所さん(同一グループ不可)にコメントをいただき、ご近所さんからコメントと署名をノートに書いてもらってください. ノート写真をウェブクラスに提出してください.
次回は、「2.電池の起電力と分解電圧」または「3 . 工業への応用」のテーマを行います。器具の都合から、テーブル毎に、同じテーマを実施できません。テーブル毎に、次回行うテーマを事前に決めておいてください。
