 🏠
🏠
 🏠
🏠
 03.
3ボルト
が生み出す洗剤と水素―
電気化学工業―
03.
3ボルト
が生み出す洗剤と水素―
電気化学工業―水を水素と酸素に熱分解しようとしたら、2500度もの高温が必要だ。 電気を使えば、室温で乾電池をふたつ直列につなぐだけで、水素と酸素に電気分解できる。 電気化学工業でどういう化成品が作られているか、調べてみよう。
| 物質 | |||
|---|---|---|---|
| 電解製造 | 電解採取 | 水溶液 : 🏞 🧪 ⚛ 塩素 、 🏞 苛性ソーダ、 (食塩電解) 🏞水素 、 ⚛ 亜鉛 | |
| 溶融塩 : 🏞 ⚛ アルミニウム | |||
| 電解合成 | 水溶液 :二酸化マンガン | ||
| 有機物 :アジポニトル | |||
| 電解精製 | 銅 | ||
| 電気透析 | 🏞 食塩 |
洗剤や漂白剤は液体の化学薬品がそのまま身近な生活に使われます。 温度と圧力で作ることができる液体や気体は灰汁やアンモニアです。 今やぼくらは電気の力を化学に使うことができる。 それが電解です。 加熱や加圧の 単位操作だけでは作れなかった化学薬品を手に入れましょう。
1 ) 2 )| モノ | 価値 /円 | 質量 / g | 体積 / cm3 |
|---|---|---|---|
| ( 電気 ) | 31 | - | - |
| 二酸化炭素 | 廃棄物 (大気放出) | 500 | 254545 |
| アルミニウム ( 溶融塩電解 ) | 24 | 75 | 27 |
固体は重量(トン)で価格を決めます。そのまま重量を測ることが多いです。 液体は体積(リットル)で価格を決めますが、液位を測ると便利です。 気体は体積( ノルマル立米)で価格を決めますが、ボンベの残量などは圧力(気圧)を測ると便利です。
電気は目にも見えず触れることもできないので計器で測るしかありません。 電力量(キロワットアワー)を、モノや価格と紐づけてイメージしましょう。
ファラデー定数は、電気量とモノの架け橋。96500C/molまたは、27kAh/molです。
ぼくらが生きていくために必要な 塩。 ナトリウムとカリウムのバランスが神経を伝わる電気信号に必要がなのだ。 なめてみれば海水に塩が含まれることがわかる。 しかし、この海水から塩を単離することは、容易ではない。 はるか太古から浴び続けた太陽の恵みによってできた岩塩を採掘するのもひとつの手だ。 しかし岩塩を算出しない日本では、海水を濃縮するのにさまざまな努力をしてきた。

先生:「工業の基本はコスト削減、効率アップ。
電気化学
で習った過電圧覚えてる?」
学生:「うーん・・・」
先生:「ちょうど
学生実験
で
分解電圧
とか
過電圧
とかの実験やっるんじゃない?」
学生:「そうそう言えば
分解電圧の実験
とかやってたかも」
先生:「最近じゃ、なんだか成人病の天敵みたいに言われている塩分だけどね、食塩は人間にとってなくてはならないものなんだ」
学生:「へえ」
先生:「
たばこと塩の博物館
行ったことある?
」
先生:「
給料(サラリー)と塩(ソルト)の語源は同じらしいんだ。
」
先生:「
岩塩
が取れるところならいざ知らず
温度で溶解度がほとんど変わらないから析出されるわけにいかず、
天日で水分を蒸発させるしかなかった。
」

平行平板電極であれば、
セル定数a=電極間距離d÷セル断面積S
です。
一般的には、導電率既知のKCl溶液などを使って、セル定数を較正します。
コンダクタンス=導電率
電気抵抗=抵抗率×長さ÷電極面積
製塩の歴史と電気透析。 海水から食塩を取り出すのに、熱エネルギーを使うより、電気エネルギーを使った法がはるかに効率がいい。 これも 電気化学 で習ったね。
イオン交換膜を使ったカンスイの製造


| プロセス |
アルミ ニウム 溶融塩電解 |
食塩電解 |
銅 電解精錬 |
亜鉛 電解採取 |
|---|---|---|---|---|
| 🏞 原料 | 食塩(岩塩) | |||
| 製品 | 亜鉛 | |||
| 理論電気量 /kAh/t | 2980 | 670 | 844 | 820 |
| 理論分解電圧 /V | 4.17 | 2.2 | 0.1×10-3 | 2.0 |
| アノード 電流密度/A/m2 | ||||
| 単槽 電圧/V | ||||
| 電気量原単位 /kAh/t | 3350 | 910 | ||
| 電解電力 ( 電力原単位 ) /kWh/t | 13400 | 2200 | 284 | 3000 |
| 電流効率 | ||||
| 電圧効率 | ||||
| エネルギー効率 7 ) |
理論分解電圧とは、アノードとカソードの平衡電位の差であって、槽電圧(浴電圧)をこれ以下に切り下げることはできません 。
8 )| 電解槽 | Ti| RuO(DSA) | NaCl aq | イオン交換膜 | NaOH aq | Ni |
| アノード 反応 | Cl2 + 2e- ← 2Cl- Eº = 1.3583V |
| カソード 反応 | 2H2O + 2e- → 2OH- + H2 Eº = -0.8285V |
| 全反応 | 2NaCl + 2H2O → 2NaOH + Cl2 +H2 |
| 理論分解電圧 | e.m.f. = 2.1868V |
食塩水を電解すると、塩素ガス、水酸化ナトリウム(苛性ソーダ)、それに水素が得られます。 これを、工業的に食塩電解(chlor-alkali electrolysis)ソーダ電解、あるいは塩素・アルカリ電解と呼ばれます。 アノードにはチタンが使われますが、 塩素過電圧を小さくするために、触媒として酸化ルテニウムを被覆したものを使います。 9 ) 。 10 )
温度や 圧力ではなしえない電気エネルギーで、原料を酸化や還元し、 塩素 や 水酸化ナトリウムを取り出すのが電解採取だ。 酸化を起こす電極を アノードと言い、還元を起こす電極をカソードと言う。 ソーダ工業と呼ばれるジャンルだ。 ソーダ工業は、電解ソーダ工業とソーダ灰工業からなる。電解ソーダ工業 の原料は食塩と電気だ。
ソーダ製品 には、塩素ガス、塩酸、 次亜塩素酸ソーダ、高度さらし粉、水素ガス、ソーダ灰などがある。 塩素や水素は気体なのでボンベにつめて出荷される。水酸化ナトリウムは強アルカリだ。 漏らすな、危険。
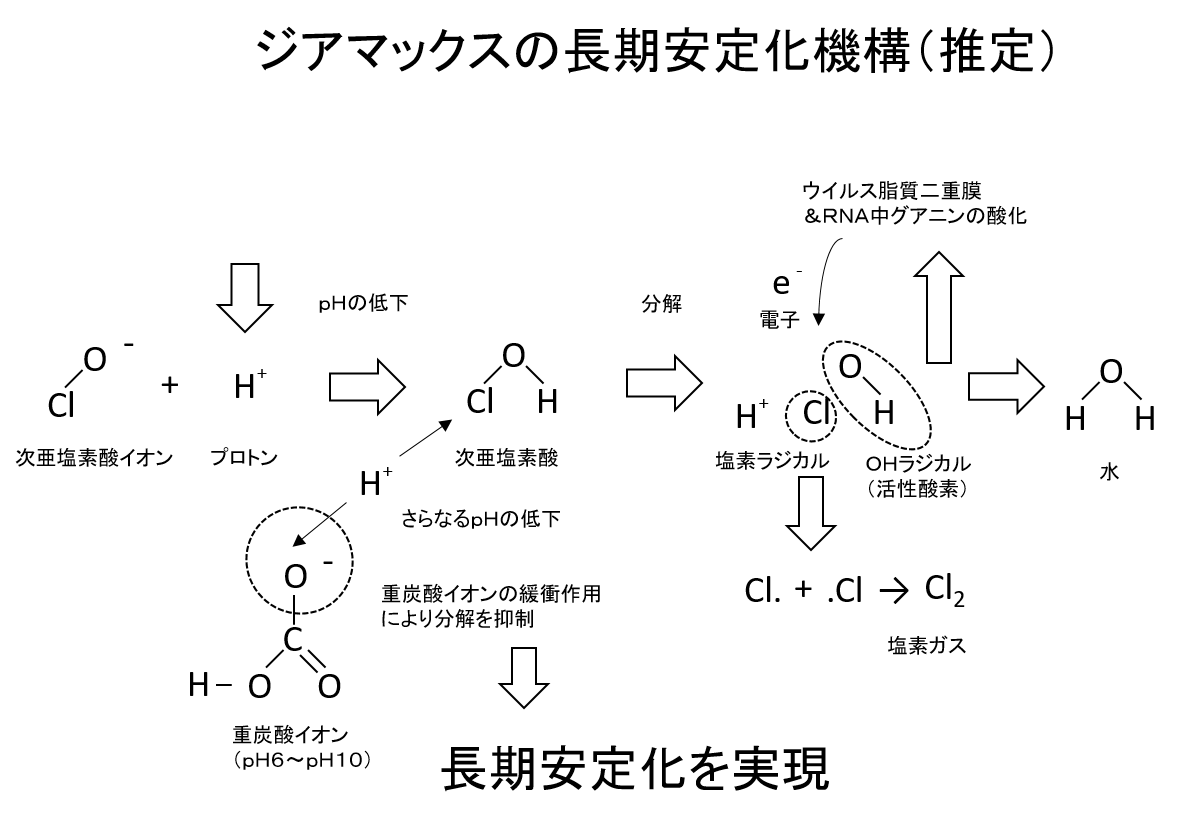
次亜塩素酸ソーダは、塩素系漂白剤に使われます。水道水の消毒にも欠かせません。
 https://edu.yz.yamagata-u.ac.jp/Public/54299/c1/C1_Project/jia.asp
https://edu.yz.yamagata-u.ac.jp/Public/54299/c1/C1_Project/jia.asp
電気分解に必要な電圧はそれほど高くないが、ファラデーの電気分解の法則の通り、生産量は電気量に比例する。 よって大量生産しようとすれば大電力を消費する。 また生産速度を上げようとすれば、多くの電流を流すことになる。 受電設備や電気配線の管理を正しく行う必要がある。


電気化学の分解電圧、 学生実験の分解電圧、 無機工業化学の電気化学工業 で取り上げた食塩電解の工場です。
電気透析
電解の化学
イオン交換膜
洗剤を作るのになくてはならない 水酸化ナトリウム(苛性ソーダ)。 これも 食塩水 の電気分解することなしにはまず作れない。 漂白剤に必要な塩素だって同じだ。 塩素が無ければ塩酸だって作れない。
出典: アイポッシュ


白金のコバルト合金。
エネルギー貯蔵のための電気化学。 電池は電気エネルギーを化学エネルギーたくわえるデバイス(無機工業化学)。 乾電池、燃料電池、リチウム電池といろいろな電池が使われてきた(エネルギー変換特論)。
水を水素と酸素に熱分解しようとしたら、2500度もの高温が必要です。 電気を使えば、室温で乾電池をふたつ直列につなぐだけで、水素と酸素に 電気分解できます。
25℃、1atmでの 平衡電位の差を理論分解電圧と言い、1.23Vです 11 ) 。 理論分解電圧は、自由エネルギーより計算され、理論稼働電圧は、 エンタルピーから計算されます 12 ) 。
化学実験Ⅰでは、下記の実験をやっていますね。
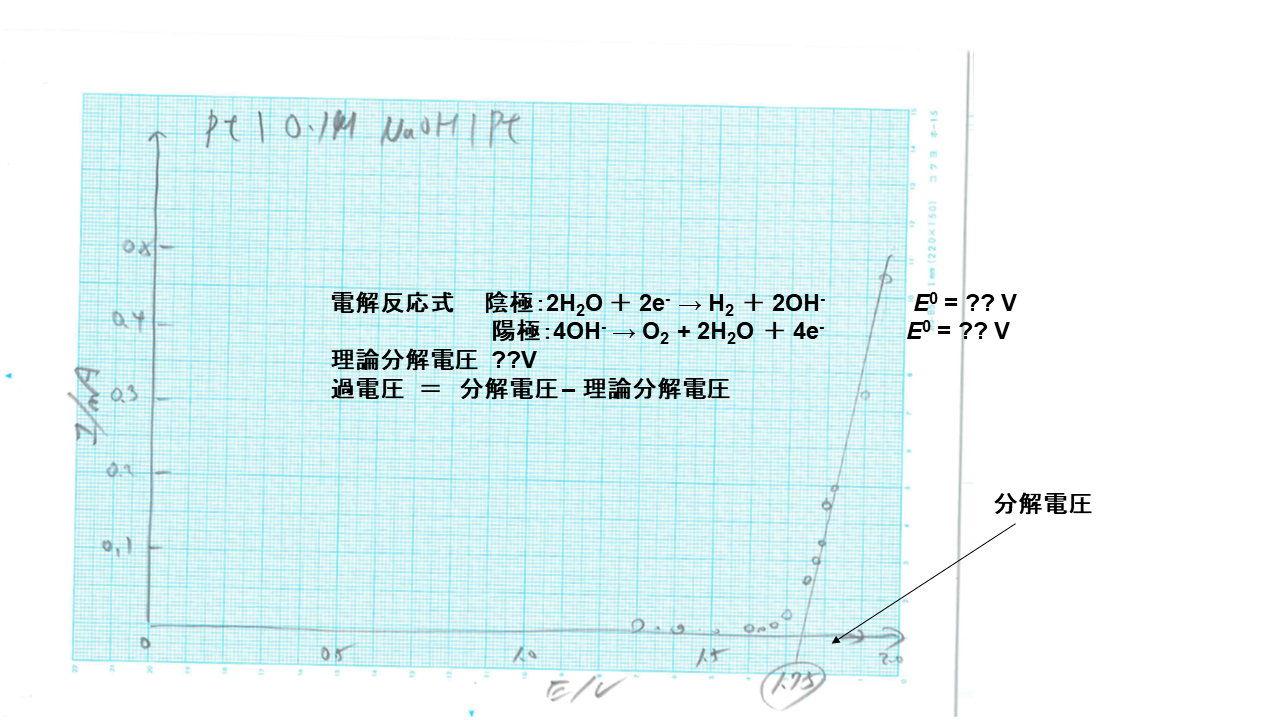
アノード、カソードに 白金を使って、水酸化ナトリウム水溶液を分極した電流‐電圧曲線です。 化学実験Ⅱの予備実験では、分解電圧は1.75Vでした。 そこから水の理論分解電圧を差し引いた過電圧は0.49Vでした。
水電解です 13 ) 。 アノードの析出物質は、酸素で、 カソードの析出物質は、水素です。 ナトリウムイオンは、電気を流す支持電解質で、電気分解には関与しません。
セラミックスを合成しようとしたら、1000度もの高温が必要だ。 電気を使えば、室温で酸化物が合成できる。 しかもたとえば電解合成した二酸化マンガンを乾電池の材料に使うと性能があがる。
野村正勝・鈴鹿輝男
最新工業化学―持続的社会に向けて―
講談社サイエンティフィク
目次
松林光男、渡辺弘,
イラスト図解 工場のしくみ
,日本実業出版社
山下正通、小沢昭弥, 現代の電気化学,
丸善
,
目次
(2012).
14
)


2024年1月21日 松木健三名誉教授がご逝去されました。