 🏠
🏠
 🏠
🏠
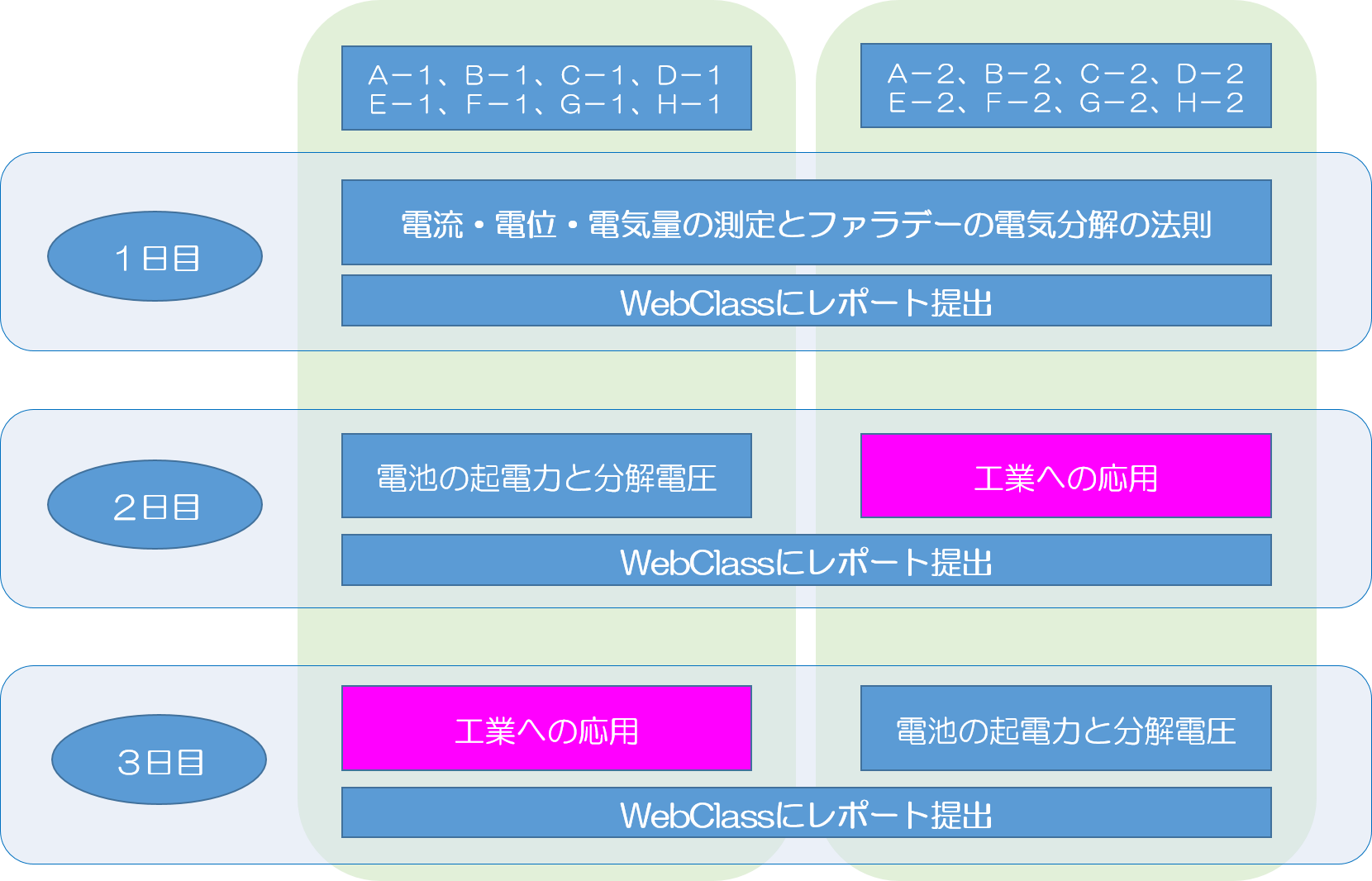
化学実験Ⅰのエネルギー化学分野は、2024年度より 化学実験Ⅱとして開講されます。
アルマイト、 エッチング、 乾電池、 ディスプレイのテーマからどれかひとつを選択してください。 時間にゆとりがある場合、ふたつ以上選択してもかまいません。 全部のテーマを終わらせる必要はありません。
「
アルマイト
はいろいろな工業製品に使われているよ。
まずは現代の電気化学, p.149のアノード処理のところを読んでみよう。」
(…続き…)
先生:「もう
電池式
はだいじょうぶだよね?」
学生:「はい」
先生:「それなら話は早い、下の電池を組んでみよう」
Al|H2SO4|Al
【製品】美しく着色されたアルミニウム 試料極にアルミニウムワイヤを用いる。アルミニウムは測定直前に研磨後、0.1M NaOHでアルカリ前処理を行い、水で十分に洗浄する。電解液に0.1M H2SO4を用い、対極にアルミニウムワイヤを用いて一定電流10mA/cm2を通電し、電位時間曲線(クロノポテンショグラム)を測定する。電流値を監視し、常に一定になるように抵抗尺を操作する。カレントフォロアと電流分割器を使うか、後述設問のガルバノスタットを使うことを推奨する。そのときの電位をエレクトロメータで読み取る。アノード酸化が終ったら、加温したコンゴーレッド(50mg/10mL)、アニリンブルー溶液(50mg/10mL)に浸漬し、酸化していないアルミニウムワイヤと着色状態を比較する。
マッチの燃えさしは,その辺に置かずに,燃えさし入れに入れる。
またAl-PETフィルムを紙やすりで磨き清浄な面を露出させ、同様に染色加工し、メタリックピンクおよびメタリックブルーのフィルムを作成する。
?設問:電流値を一定にする操作を自動的に行うにはどのような回路を使えば良いか? ?設問:硫酸の替わりにアジピン酸アンモニウムやホウ酸を用いた場合にはどんな工業製品に応用できるか?1)
基礎となる講義 電気化学: 工業製品への応用1―アルマイト・エッチング―
アルマイト加工はアルミサッシなどの建材に使われている.このアルミサッシの抵抗をテスターで測ると,OLと表示されることがおおく,その抵抗は高い. アルマイト処理は,奥が深いと痛感され,LCRメータでインピーダンスを測ると,1cm2あたり,Cp=2nFの静電容量を示す. 【春休みの自由研究】アルミニウムの建材に電気を流すには!
「
エッチング
はいろいろな工業製品に使われているよ。」
先生:「アルミニウムを塩化鉄につけるとどうなるか?」
Al|FeCl3
先生:「塩化鉄は当然、電離するから・・・」
FeCl3 ↔ Fe3+ + 3Cl-
先生:「3価の鉄は次の平衡に達して・・・」
Fe2+ ↔ Fe3+ + e- ( * )
先生:「これと競合して・・・」
Al ↔ Al3+ + 3e- ( * )
先生:「どっちの平衡反応の酸化還元電位が高いか?」
学生:「鉄イオンの平衡の方かな?」
先生:「そう!___V」
学生:「うわっ高っ!」
先生:「そう、だから鉄ばかりでなく銅までも腐食することができる」
(・・・続く・・・)
【製品】メタリックなネームプレート 40wt%塩化第二鉄FeCl3水溶液を10mL調整し、さらに濃塩酸HClを1mL加えて腐食液とする。 Cu-PET、Fe-PET、Al-PETフィルムを適当な大きさに切り、紙やすりで研磨し清浄な面を露出させ、ビニールテープを貼ってマスキングする。 また染色したAl-PETではそのままビニールテープでマスキングする。マスキングを自分の好きな形(自分のイニシャルなど)を残して切り取る。 着色していない場合はPET面から字が読み取れるように左右反転してマスキングすると美しく仕上がる。マスキングされていない金属部分を腐食液で腐食溶解する。 腐食液を水洗いし、マスキングを剥がして水洗いし、乾燥する。黒ラシャ紙を台紙にしてメタリックネームプレートを作成する。突然激しい溶解が起きることがあるので、操作はドラフト内で行う。 またPETフィルムは弾力があり、溶液を弾き飛ばすことがあるので保護眼鏡などを着用して実験する。 ?設問:銅は鉄よりもイオン化傾向が小さいのになぜ塩化第二鉄によって腐食されるのか? ?設問:銅および鉄をエッチング加工して得た工業製品をそれぞれ挙げよ。
小林一也, 工業技術基礎 , 実教出版 , プリント配線の基礎知識 , p.101, (2002).基礎となる講義 電気化学: 工業製品への応用1―アルマイト・エッチング―
電池
はいろいろな工業製品に使われているよ。
(・・・続く・・・)
【製品】発光ダイオードを明るく長持ち、 アルカリマンガン乾電池 正極活物質として、電解二酸化マンガンを用いる。活物質30mgにグラファイト30mgを良く混ぜ、 テフロン分散液を専用駒込めピペット(ポリポイト)で2~3滴加えて乳鉢上で良く混練し、 ラバー状とし正極合剤とする。正極集電体としてニッケル(Ni)を用い、 この集電体の先端に正極合材を落ちないようになすりつけて試料電極とする。 電解液に9M KOH5mLをビーカーに入れ、対極に亜鉛(Zn)を用いて電池を作成する。 この電池を2個直列繋ぎにし、並列繋ぎにした発光ダイオードを点灯させ、時間とともに電圧がどのように変化するかを記録する。 濃アルカリが眼に入ると失明の恐れがあるので保護眼鏡などを着用して実験する。
Ni | MnO2 ,C | KOH | Zn
?設問:取り出せたエネルギーは何Jか? それは活物質の量に対して何%か? ?設問:実用化されている電池の種類とそれらの電池を利用する工業製品をあげよ。 正極合材の調整(左図) 電解セル(中央図) 点灯したLED(右図)
CMCを使ったアルカリ電池の作り方(Google Docs)
【製品】スイッチひとつで文字が表示される未来派ディスプレイ
エレクトロクロミズムによってディスプレイを作成する。0.02M K3[Fe(CN)6]水溶液と0.02M FeCl3水溶液をそれぞれ10mLずつ作る。
試料極と対極によく洗浄したPtを用いる。電解還元直前に0.02M K3[Fe(CN)6]水溶液と0.02M FeCl3水溶液を同時に混入し、電流密度40μA/cm2、120s通電する。
試料極Pt表面にプルシアンブルーが析出したら、0.01M H2SO4水溶液で洗浄する。
Pt/プルシアンブルー/1M KCl/Ptのような電池を作成し、アノード側、初期自然電位、カソード側 -0.459V vs. Ag/AgClを参考に電位を変化させ色の変化を観察する。
Pt|0.02M K3[Fe(CN)6],0.02M FeCl33|Pt
Pt|プルシアンブルー|1M KCl|Pt
