無機ナノシート液晶の発見と展開. 中戸晃之, 粘土科学第59巻第2号45-51(2020).
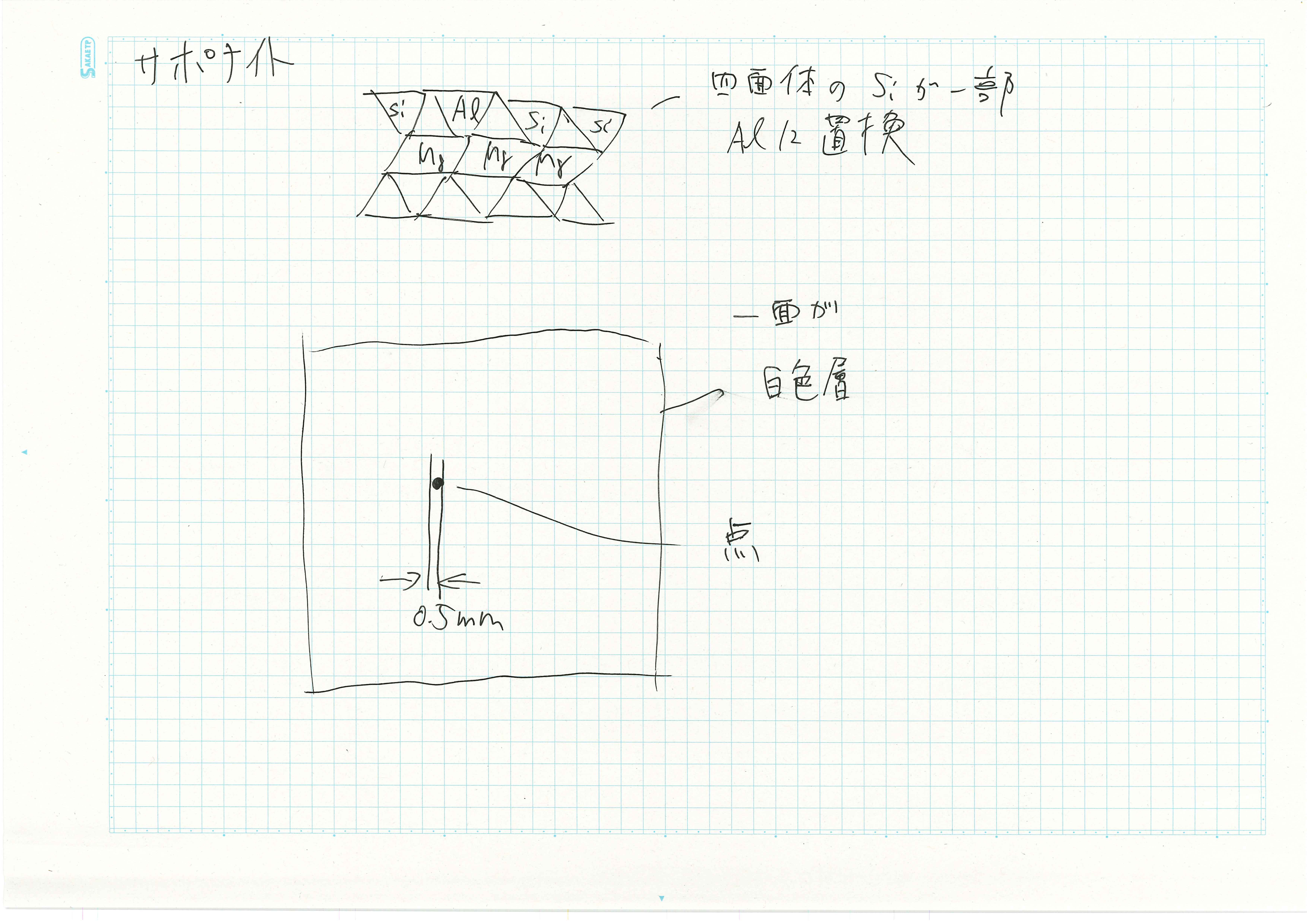
表1に粘土鉱物の分類を示す.粘土鉱物には,層状ケイ酸塩鉱物であるカオリナイト族のカオリナイト,スメクタイト族のモンモリロナイト,ヘクトライト,スチーブンサイト,サポナイトなどの種類がある. またモンモリロナイトを主成分とする粘土の総称をベントナイトと呼ぶことがある.モンモリロナイトを主成分としているが,何%以上入っていればベントナイトとするといった定義は存在せずモンモリロナイトが多少入っていればベントナイトと呼ぶことができる1).
| 族 | 種 | 化学式 | 製品名 | 製造方法 | 用途 |
|---|---|---|---|---|---|
| カオリナイト (1:1層) | カオリナイト | 1:1層で、層間に水がないため、焼結可能。陶磁器などに使う(※)。 | |||
| スメクタイト (2:1層) | 🧪 モンモリロナイト |
Nax(Al2-xMgx)Si4O10(OH)2·4H2O(X<0.33)
|
クニピア-F | 精製 | ベントナイトの主成分。 1:2層で、高温でも固まらない。鋳鉄の鋳型などに使う。 |
| Li+モンモリロナイト |
Lix(Al2-xMgx)Si4O10(OH)2·4H2O(X<0.33)
|
クニピア-M | 精製 | ||
| サポナイト |
NaxMg3(Si4-xAlx)O10(OH)2(X<0.33)
|
スメクトン-SA | 水熱合成 | ||
| スチーブンサイト | Na0.3Mg3-xSi4O10(OH)2 | スメクトン-ST | 水熱合成 | ||
| 🧪 ヘクトライト | Na0.3(Mg,Li)3-xSi4O10(OH)2 | スメクトンSWN | 水熱合成 | ||
| ヘクトライト-F | スメクトンSWF | 水熱合成 |
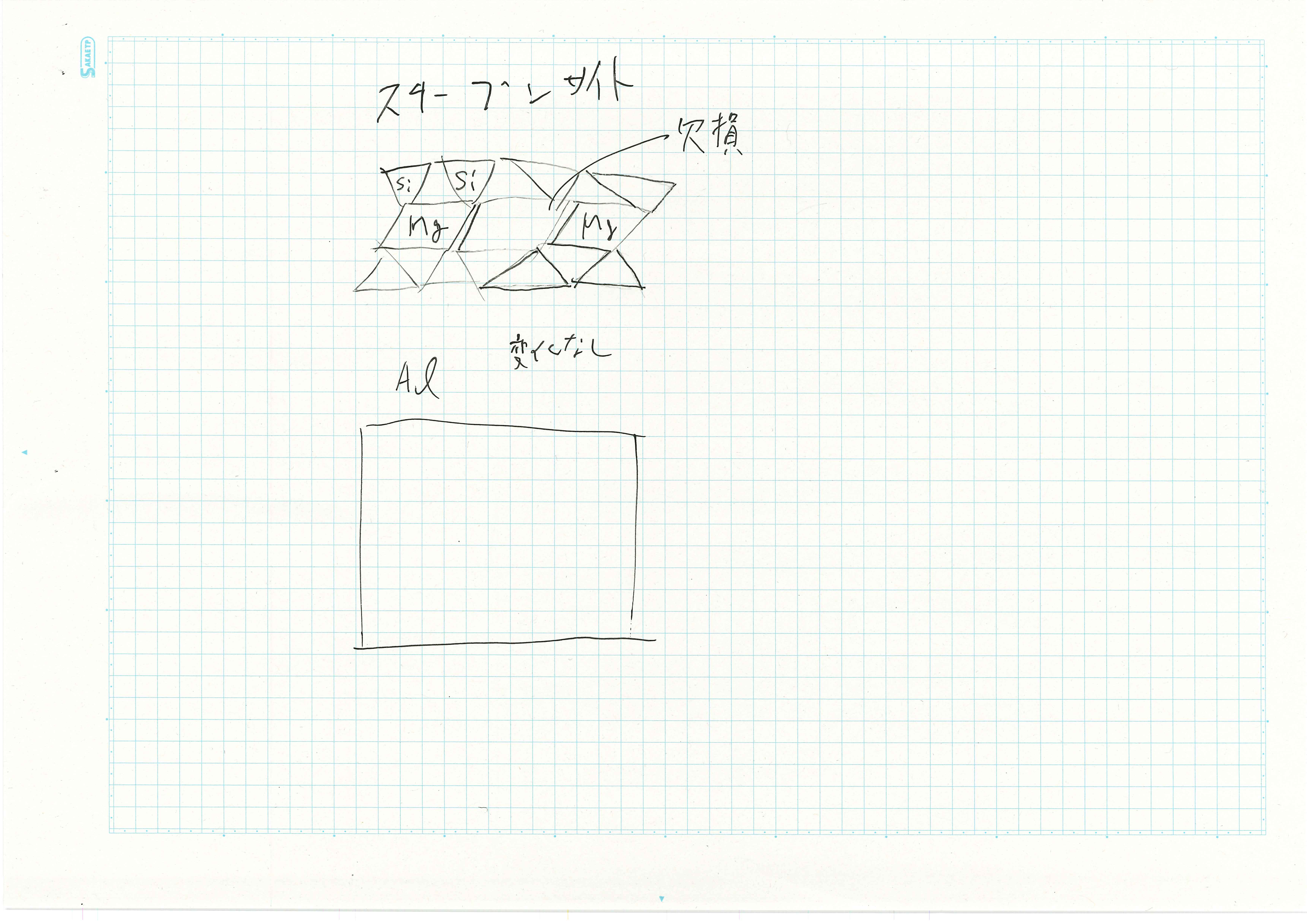
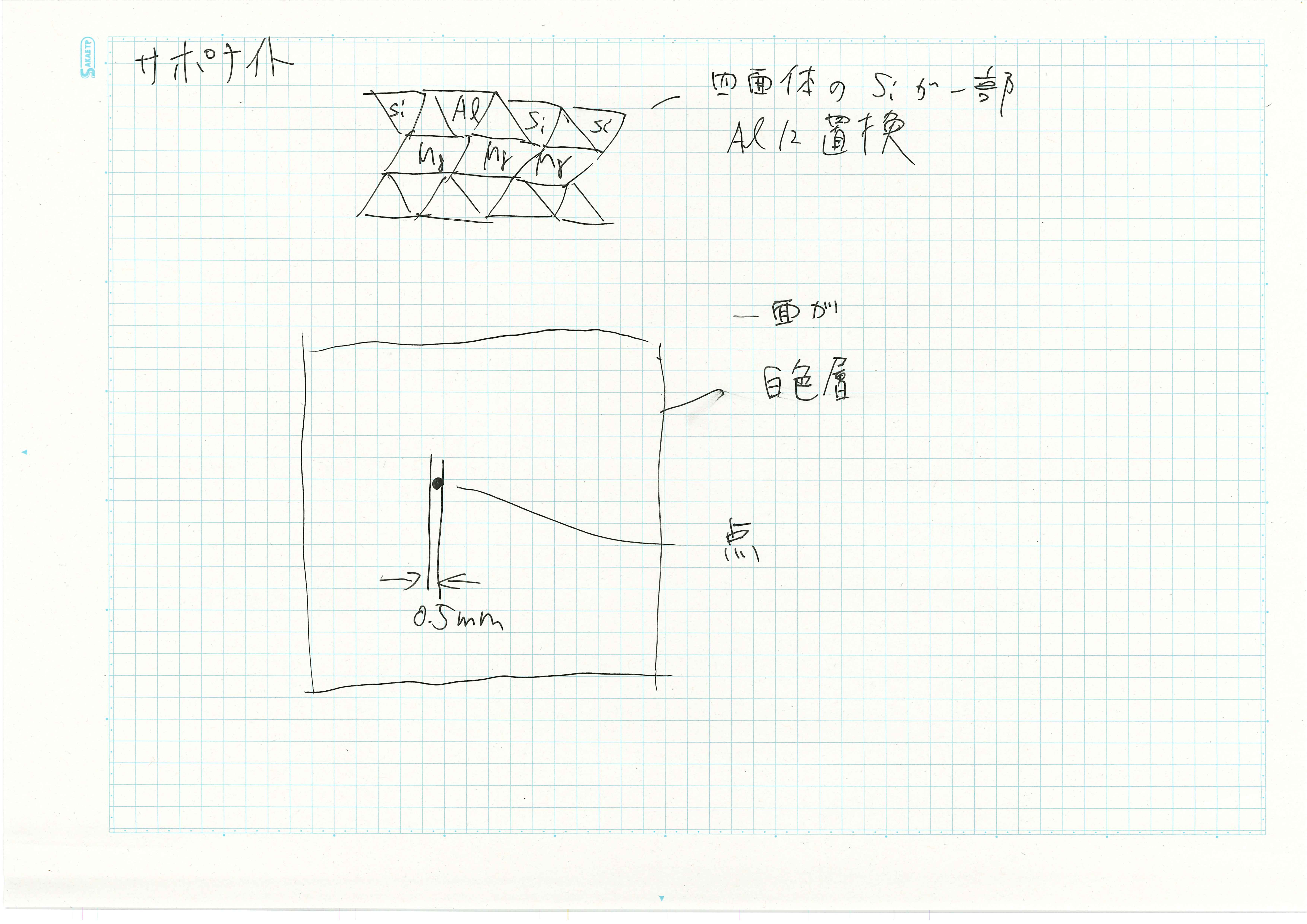
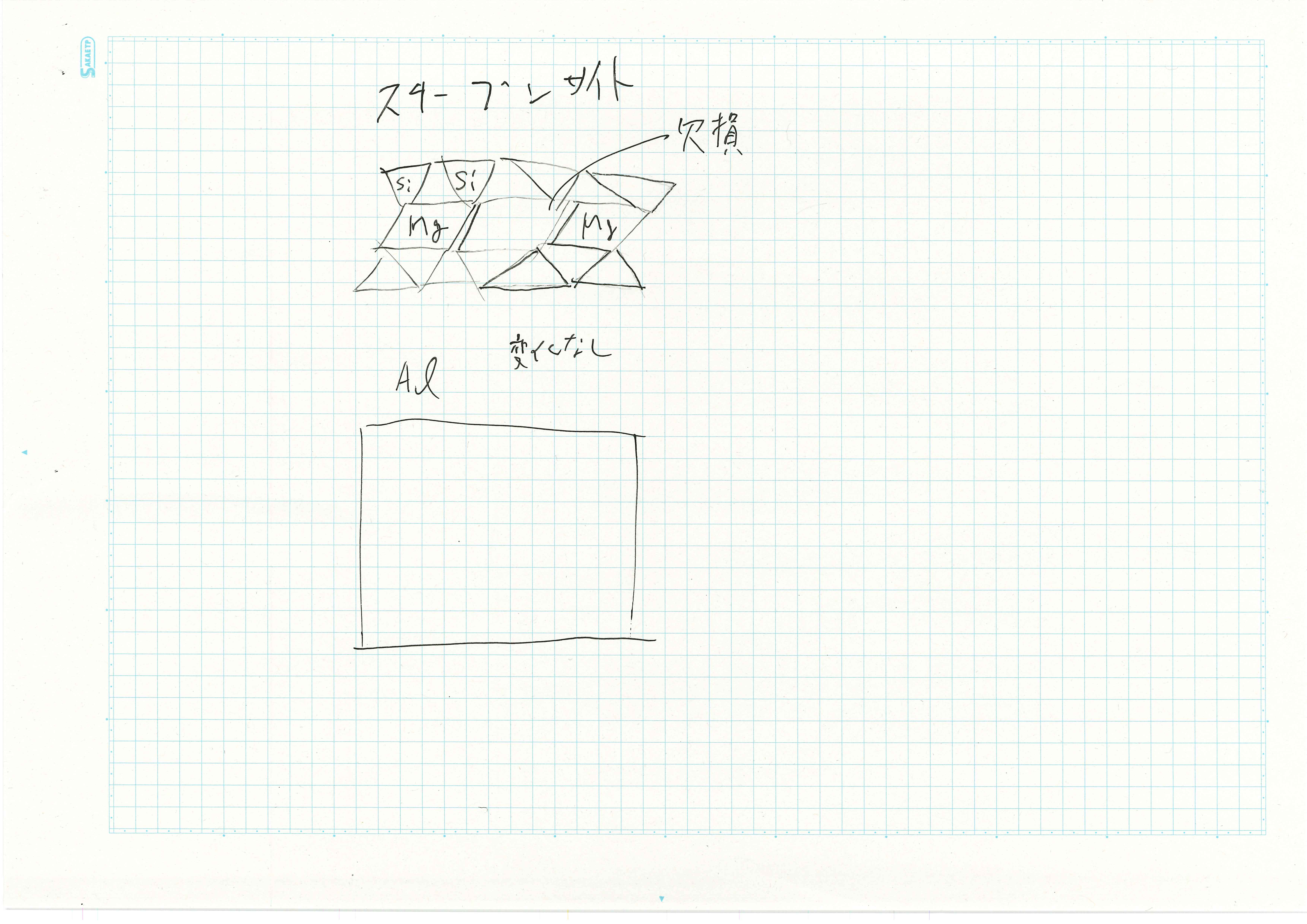
図1に粘土鉱物の結晶構造の模式図を示す.粘土鉱物であるスメクタイト族のモンモリロナイトは,アルミニウムイオンと6つの酸素または水酸基の八面体からなるシートと,八面体を挟むようにケイ素と4つの酸素の四面体からなるシートにサンドイッチされた構造をとっている.八面体シートのアルミニウムイオンが一部マグネシウムイオンに置換される.この置換は通常同じくらいの半径をもつイオン間で起こるので結晶構造に大きな変化がなく同型置換と呼ばれている.同型置換が起こることによって,結晶構造内で電荷の不足が起こり,その負電荷を補うように層間や表面に水和したカチオン(アルカリ金属,アルカリ土類金属)が配置される.同型置換によって生じる負電荷は外囲条件の影響を受けることなく一定なので永久電荷と呼ばれている1).負電荷を帯びている粘土シートと正電荷をもつカチオンが離れているので,双極子モーメントを持つ.
層間や表面に配置されたカチオンはイオン交換によって,イオン濃度にも依存するが原子価の高いイオンほど,同じ原子価の場合はイオン半径が大きいほどより選択的にカチオンが層間や表面に挿入(インターカレート)される.挿入されるカチオンの序列は,以下の通りになっており,プロトンは粘土鉱物結晶層面に存在する酸素と水素結合することにより多価のカチオンより優先的に結晶層間にインターカレートする.無機カチオンより分子量の大きい有機カチオンはより優先的に層間にインターカレートする.2). Li+<Na+<K+<Mg2+<Ca2+<Ba2+<Al3+<Fe3+<H+
参考文献
粘土分散液は,粘土ではない.粘土は鉱物であり,粘土分散液は粘土粒子と分散媒である水との複合材料である.表2に粘土分散液の粒径と導電率を示す.
| 試料名 (製造元、型番) | 粒径/nm | 導電率/μS/cm | pH | 4wt%粘度/mPa·s(60 rpm) |
|---|---|---|---|---|
|
スチーブンサイト2wt%/水分散液
( クニミネ工業、 スメクトン-ST 2wt%/水分散液) | 30±10 | 2450 | 11 | 1000 |
| ヘクトライト2wt%/水分散液
( クニミネ工業、 スメクトン-SWN 2wt%/水分散液) | 50 | 1594 | 10.7 | 4000 |
| サポナイト2wt%/水分散液
( クニミネ工業、 スメクトン-SA 2wt%/水分散液) | 100 | 1114 | 9.8 | 4000 |
| モンモリロナイト2wt%/水分散液
(クニミネ工業、 クニピア-F 2wt%/水分散液) | 350±250 | 636 | 10.1 | 300 |
スメクタイト族の粘土鉱物は溶媒に分散させると,積層された粘土シートの層間に水が配位されたカチオンが入り込むことで膨潤する.この現象を剥離と呼ぶ3).
図3に粘土鉱物のスメクタイト族が剥離する際の模式図を示す.剥離することで粘土シートの層間が広がり,粘性の高い液体となる.一方カオリナイト族では八面体シートと四面体シートが1:1型構造をとっているため,粘土シートの層間に水が入り込みづらいので,剥離せず溶媒に分散させづらい.
剥離した状態の粘土分散液でも,粘土シートの負の電荷と水和したカチオンの正電荷とで双極子モーメントが生じる.このような双極子モーメントを持つクラスターを,ダイレクターと呼ぶ.粘土分散液は通常,粘性力が支配的だが,振動を受けることで流れが生じたり,電場がかかることで慣性力が支配的になる.この現象は,粘土分散液の液晶性の発現に寄与している.
図4に粘土分散液の概念図を示す.ヘクトライト粘土鉱物は厚さ1 nmに対して幅50 nmの極めて大きい構造異方性を持った粘土シートからなっている.剥離する前の粘土シートの層間距離は1 nm以下と言われており,溶媒に分散させて剥離することで層間距離が10 nm程度になる.剥離する際に粘土/水分散液中の粘土シートは完全に積層性を失わずに,粘土シートが連なることでファイバーのような状態になる.この状態の粘土シートを粘土ファイバーと名付ける.ファイバーが長くなることで立体構造を形成し,ゲル化している.粘土ファイバーの大きさは,一般的なコロイドの大きさから推定し数十から数百nmと推定している.


粘土/分散液のような,層状酸化物を溶媒に分散させて,層状結晶を剥離させた材料は液晶としての性質を持つことが報告されている1).液晶とは,固体の光学的異方性と液体としての流動性を合わせもっており,電場などの外場により容易に配向状態を変化させ,その配向に応じて異なる物性を示すものと述べられており,液晶相は様々な秩序をとりネマチック,ラメラ,スメクチック,キュービック,ディスコチック相などがある2).
表にナノシート液晶の歴史を示す.無機ナノシートは層状結晶が溶媒中で剥離することが得られる厚みが約1 nm,幅が数百nm~10 µm以上となり極めて大きい構造異方性を持っていることが特徴である.粘土鉱物のナノシートの液晶については初めて報告されたのは1938年でベントナイトのゾルが複屈折を示すと報告されたが,そこから60年たつまであまり目立った報告がされていなかった.しかしこの論文に対して粘土鉱物ナノシートの液晶相転移は誤認ではないかと批判がされて2006年の論文でようやく確立された.
2001年の層状リン酸アンチモンのナノシート液晶の報告が粘土鉱物以外の層状化合物での最初の報告だった.これを皮切りに,2000年代以降様々な種類の無機ナノシート液晶の報告がされるようになった.粘土鉱物ナノシートの応用や活用の事例として2017年にハイドロタルサイト(LDH)で高い水酸化物イオン伝導を示し10-1 S m-1であることが報告された12).これは市販のプロトン交換膜(例えば,Nafion)のプロトン伝導にに匹敵するため燃料電池などへの応用が期待されている.
| 年代 | 研究者 | 内容 |
|---|---|---|
| 1938 | Langmuir3) | ベントナイトのゾルが複屈折を示し液晶性について報告. |
| 1963 | Manesh Jら4)5) | ベントナイトの懸濁液において電気複屈折が報告. |
| 1994 | Kleinfeldら8) | 層状化合物が溶媒中で積層性を失い単一の層になることが報告.以降この現象は剥離と言われるようになった. |
| 1995 | 笹井ら6) | 水溶液中のモンモリロナイトが電場によって電気複屈折することが報告. |
| 1996 | 笹井ら7) | 水溶液中のモンモリロナイトが磁場によって電気複屈折することが報告. |
| 1996 | Gabrielら9) | 粘土コロイドの液晶相転移の相図が初めて報告. |
| 2001 | Gabrielら10) | 層状リン酸アンチモンH3Sb3P2O14の剥離した単ー層ゲルが液晶相であることが報告. |
| 2002 | 中戸ら11) | 層状ニオブ酸塩K4Nb6O17の剥離ナノシートのコロイドが液晶相を持つことが報告. |
| 2006 | Michotら12) | 粘土鉱物ナノシートでの液晶相転移が確立.天然のノントロナイト,ネマティック相 |
参考文献(あとで全体と統合)
- 1)宮元展義,山本伸也.”無機ナノシート液晶:二次元無機高分子が自発形成する組織化構造”高分子論文集,Vol.73,No.3,pp.262-280(2016)
- 2)野村正勝,鈴鹿輝夫男.”最新工業化学持続的社会に向けて”,講談社,2015,pp.194-197
- 3) Langmuir, I.J. Chem. Phys., 6 (1938) , pp873–896.
- 4)Manesh J. Shah, Donald C. Thompson, and Cleve M. Hart,Phys. Chem., 67, 6,pp1170–1178(1963)
- 5)M. J. Shah,J. Phys. Chem.,67,10,pp2215–2219(1963)
- 6) Ryo Sasai and Kiwamu Yamaoka,J. Phys. Chem., 99, 50,pp17754–17762(1995)
- 7)Ryo Sasai, Natsuki Ikuta, and Kiwamu Yamaoka,J. Phys. Chem.,100, 43,pp17266–17275(1996)
- 8) Kleinfeld, E. R. and Ferguson, G. S.,Science,265,pp370–373.(1994)
- 9)Gabriel,J.-C.P.,Camerel,F.,Lemaire,B.J.,Desvaux,H.,Davidson,P.and Batail,P.,Nature, 413, pp504–508(2001)
- 10) Miyamoto, N. and Nakato, T.Adv. Mater.,14,pp1267–1270(2002)
- 11)L.J.Michot,I.Bihannic,S.Maddi,S.S.Funari,C.Baravian,P.Levitz,and P.Davidson,Proc.Natl.Acad.Sci.USA,103,44,pp16101–16104(2006)
- 12)PENGZHAN SUNRENZHI MA XUEYIN BAIKUNLIN WANGHONGWEI ZHU AND TAKAYOSHI SASAKI,SCIENCE ADVANCES,Vol.3,No.4 (2017)
1.1.6ゲルについて
ゲルとは,コロイドの分類の一つである.流動性をもつコロイド溶液のことをゾルと呼び,ゾルが流動性を失って固まったものをゲルと呼ぶ.またゲルを乾燥させたものをキセロゲルと呼び,熱水を加えるとことでゾルに戻る.田中らによると高分子ゲルは,高分子の網目と溶媒との二つの成分からできていて,高分子網目が液体を包み閉じ込めて液体が流れるのを防いでいる.したがって高分子ゲルは見かけ上液体と固体の中間の物質状態をとっていると述べられている1).ゲル形成は高分子鎖間の橋架けによる三次元的な編み目の形成によって起こり,この橋架けを架橋という.図に高分子鎖が作る架橋形成の例を示す.共有結合やクーロン力,水素結合,配位結合によって高分子鎖が固定されることで三次元的な網目が形成される.この網目の形成によってゾルからゲルへと転移し液体としての流動性を失い,固体状になる.
またゲル形成には前述の共用結合などの化学結合だけではなく,凝集や分子鎖同士の絡み合い,分子配向(ラメラ構造)などでも三次元の網目を形成する2).特に粘土分散液のような無機ナノシートからなるゲルは,配向して液晶からなるラメラ構造をとるといわれている3).
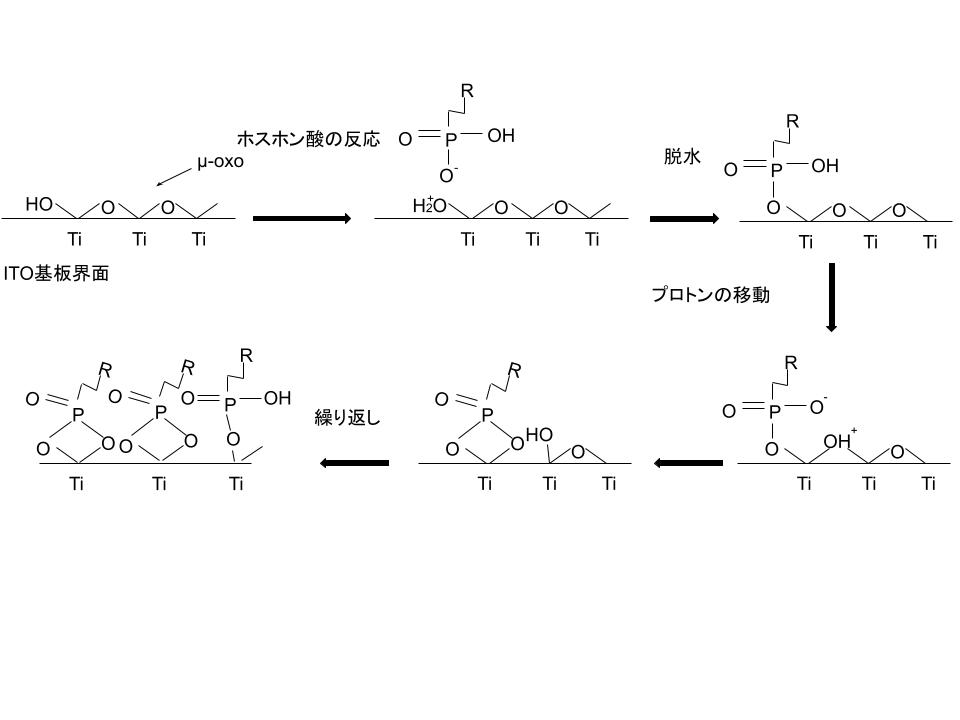
また,界面での固定点として自己組織化単分子膜(Self-Assembled Monolayer,SAM)がある.図にITO基板界面 上におけるホスホン酸SAM形成の模式図を示す.ホスホン酸誘導体はITOなどの金属酸化物の表面処理・改質剤として用いられているTiO2の結合の端面にある水酸基とホスホン酸が反応しすることで固定点となる.ホスホン酸のプロトンが移動することで連続的に反応し界面上に膜が形成される4).
参考文献(あとで全体と統合)
- 1)田中 穰,長田 義仁,”高分子ゲル”,熱硬化性樹脂,15巻4号,p. 195-208(1994)
- 2)中西 英二,”機能化ポリペプチドゲル”,高分子,48 巻 6 号,p. 408-411(1999)
- 3)Sano, K., Igarashi, N., Ebina, Y. et al.”A mechanically adaptive hydrogel with a reconfigurable network consisting entirely of inorganic nanosheets and water”. Nat Commun 11, 6026 (2020).
- 4)J. Schwartz, M.J. Avaltroni, M.P. Danahy, B.M. Silverman, E.L. Hanson, J.E. Schwarzbauer, K.S. Midwood, E.S. Gawalt.”Cell attachment and spreading on metal implant materials Mater”. Sci. Eng. C, 23, pp. 395-400 (2003)
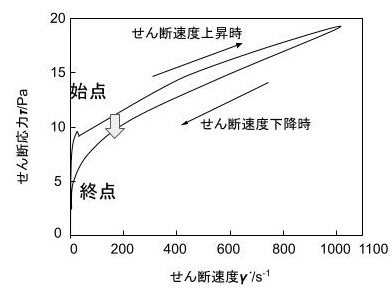
高分子学会によると,物質に力が加わることで物質が変形する.その際の変形の原因は,弾性,塑性,粘性という3タイプに分けられる.弾性の場合はフックの法則,塑性の場合はヒンガム流,粘性の場合はニュートン流として取り扱いができる.高分子化合物によくみられる塑性変形は複雑な挙動を示す場合が多い.力が働いているときは,粘性流体であり,力がなくなると弾性体になる物質状態が存在する.これをチキソトロピー性と言うと述べられている1).
図に粘土/水分散液のヒステリシスループを示す.クニミネ工業によれば,粘土/水分散液中の粘土粒子は単位層が負の電荷,端面が正の電荷を帯びている.粘土/水分散液を静置すると,負電荷を帯びた層面と正電荷を帯びた端面がお互いに引き合いedge to face(端面-層面結合)の立体的な会合構造を形成する.これをカードハウス構造と呼ぶ.高せん断速度領域では,カードハウス構造が破壊されて粘性が低下し,低せん断速度領域では,edge to faceの立体的な会合構造が形成され,高い粘性を示す.これを粘土/水分散液が持つチキソトロピー性の由来であると述べている.2)
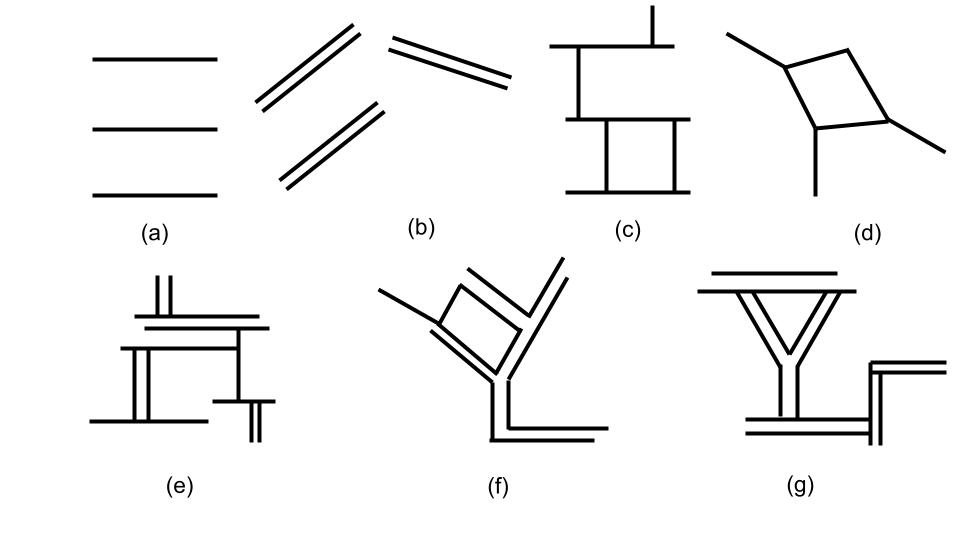
粘土/水分散液中の粘土シートの集合状態にはいくつかありOlplenの図が参考にされる.図に粘土シートの集合状態を示す.粘土ハンドブックとによれば(a)分散または解膠または非架固状態,(b)凝集しているが架固していない状態(face to face会合),(c)edge to faceの架固しているが分散している状態,(d)edge to edgeの架固しているが分散している状態,(e)egde to faceの架固し,かつ凝集している状態,(f)edge to edgeの架固および凝集している状態,(g)egde to face,edge to edgeの架固および凝集している状態の7形態に分けられると述べられている3).
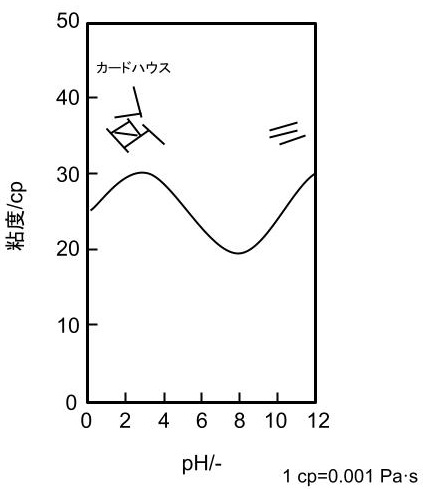
図にモンモリロナイト/分散液のpHによる粘性挙動を示す.鬼形によるとモンモリロナイト/分散液の粘度はpHに依存すると述べられており,pHが7から9.5で最も粘性は低下する.アルカリ領域では,pHが9.5から12程度に増加するとともに粘性も増加する.酸性領域では,pHが7.5から4に低下すると粘性は増加し,pH4以下になると逆に粘性は低下する傾向を示す.モンモリロナイト結晶端面の等電点はpH7付近であり,酸性領域では,端面はプラス電荷となりegde to face会合は強くなる.pH4付近の粘度の増加はegde to face会合であるカードハウス構造の形成の発達のためと考えられる.pH4以下での粘度低下は,層間に優先的に吸着されるH+によるNa+とのイオン交換による膨潤性,分散性の低下のためと考えられる.pH4以上ではプラス電荷を有する端面の電荷密度が低下し,カードハウス構造が破壊せれるため粘度が減少し,アルカリ領域下では,層面,端面ともにマイナスの電荷になりface to face会合の発達により粘性が増加すると述べられている4).
参考文献
- 1)高分子学会.”チキソトロピー”,高分子,57(2008)p. 987b
- 2)クニミネ工業株式会社,”クニピア・スメクトン”,クニミネ工業株式会社,https://www.kunimine.co.jp/products/kunipia_sumecton.html
- 3)日本粘土学会編.”粘土ハンドブック”.第二版,技報堂出版株式会社,1987,1354p.
- 4)鬼形正伸.”ベントナイトの特性とその応用”.粘土科学,46(2007), p. 131-138.
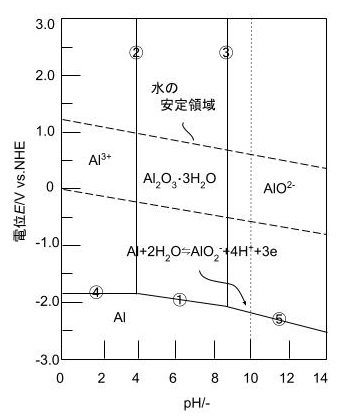
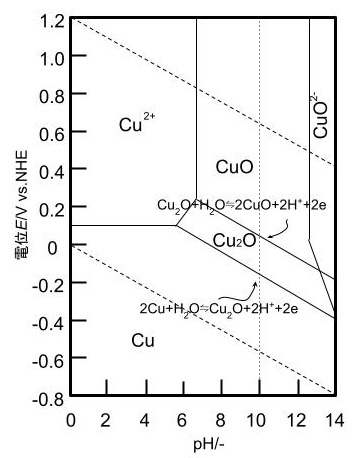
金属の腐食や安定性を考えるには,酸塩基反応,酸化還元反応,錯体形成反応の3種類が考えられる.その中の酸塩基反応を横軸,酸化還元反応を縦軸にとり化学種の安定域を図示したものを電位-pH図という.電位-pH図が創始者のPourbaixの名前をとりPourbaix Diagramとも呼ばれる1).アルミニウムと銅の電位-pH図を図と図に示す.図の電極電位とpHに関する領域図は基準となる溶存イオン濃度10-6Mの時のものである.通常この領域は溶存イオン濃度によって変化する.
ここでは特にアルミニウムの反応についての説明を行う.アルミニウムに関する存在化学種をAl,Al3+,Al(OH)3,AlO2-とする.各々の化学方程式を①~⑤として図示したものが図となる.
2.2Al3++3H2O⇋Al2O3+6H+
3.Al2O3+H2O⇋2AlO2-+2H+
4.Al⇋Al3++3e
5.Al+2H2O⇋AlO2-+4H++3e
さらにPourbaix2)によれば中性領域の時にAlの表面に生成する皮膜,腐食生成物は熱力学的に最も安定なのがHydrargillite(Al2O3·3H2O)と書かれているが,そのほかにもBayerite(Al2O3·3H2O),Bohmite(γ-Al2O3·H2O),Corundum(α-Al2O3),Amorphous hydroxide(Al(OH)3)が挙げられている.
スメクタイト族の粘土2wt%分散液のpHは10付近であるので,アルミニウムは粘土分散液中で図に示した⑤の反応が-2.1 Vで起き腐食されることが読み取れる.
参考文献
- 1)世利修美.”アルミニウムの腐食・防食研究における電位–pH図と分極曲線の基礎”,軽金属,57,8号,pp. 371-380(2007)
- 2)M. Pourbaix, ”Atlas of Electrochemical Equilibria”,Pergamon Press,(1966)
1.2目的
粘土は化粧品や鋳物,塗料など身近にある様々なものに使われており,千以上の用途を持つと言われている.そんな粘土を水に分散させた粘土/分散液の電気的性質はほとんど議論されておらず未解明点が多い.私は3年間の研究で粘土/水分散液を使ったエネルギーデバイスの可能性を探った.本研究の目的は粘土/水分散液を使ったエネルギーデバイスの可能性を探っている最中に出会った現象をまとめ,粘土/水分散液の導電機構の考察を行った.
2.◇ 実験方法
2.1準備
2.1.1 使用試薬
表に使用したスメクタイト族を示す.粘土鉱物を水などの溶媒に分散させ目的の固形分濃度の粘土分散液を使用した.
| 名称 | 略称 |
|---|---|
| モンモリロナイト | KPF |
| サポナイト | SA |
| ヘクトライト | SWN |
| スチーブンサイト | ST |
表に実験で使用した試薬を示す.使用した粘土分散液は10wt%以上の高濃度品は粉末を使用し自作し,1wt%以下の低濃度粘土分散液は精製水で希釈し撹拌子(AS ONE,3-6657-03,Tool ID4876)を用いてスターラー(AS ONE,CHS-180,Instrument ID618)600rpmで30分撹拌子は自作した.
| 名称 | 略称 | Sample ID | 提供元 |
|---|---|---|---|
| モンモリロナイト2wt%分散液 | KPF2wt%分散液 | 14483 | クニミネ工業 |
| サポナイト2wt%分散液 | SA2wt%分散液 | 14442 14521 |
クニミネ工業 |
| ヘクトライト2wt%分散液 | SWN2wt%分散液 |
14414 14527 14528 14522 |
クニミネ工業 |
| イオン増量ヘクトライト2wt%分散液 | イオン増量SWN2wt%分散液 | 14285 | クニミネ工業 |
| イオン低減ヘクトライト2wt%分散液 | イオン低減SWN2wt%分散液 | 14285 | クニミネ工業 |
| ヘクトライト3wt%分散液 | SWN3wt%分散液 | 14519 | クニミネ工業 |
| ヘクトライト5wt%分散液 | SWN5wt%分散液 | 14603 | クニミネ工業 |
| イオン増量ヘクトライト5wt%分散液 | イオン増量SWN5wt%分散液 | 14604 | クニミネ工業 |
| イオン低減ヘクトライト5wt%分散液 | イオン低減SWN5wt%分散液 | 14605 | クニミネ工業 |
| ヘクトライト15wt%分散液 | SWN15wt%分散液 | 14416 | クニミネ工業 |
| スチーブンサイト2wt%分散液 | ST2wt%分散液 |
14564 14444 14445 14520 |
クニミネ工業 |
| スチーブンサイト5wt%分散液 | ST5wt%分散液 | 14606 | クニミネ工業 |
| イオン増量スチーブンサイト5wt%分散液 | イオン増量ST5wt%分散液 | 14607 | クニミネ工業 |
| イオン低減スチーブンサイト5wt%分散液 | イオン低減ST5wt%分散液 | 14608 | クニミネ工業 |
| NaOH調製ヘクトライト2wt%分散液(pH13) | NaOH添加SWN2wt%分散液 | 14543 | クニミネ工業 |
| CH3COOH調製ヘクトライト2wt%分散液(pH7) | CH3COOH添加SWN2wt%分散液 | 14545 | クニミネ工業 |
| H2SO4調製ヘクトライト2wt%分散液(pH7) | H2SO4添加SWN2wt%分散液 | 14544 | クニミネ工業 |
| NaOH調製スチーブンサイト2wt%分散液(pH13) | NaOH添加ST2wt%分散液 | 14540 | クニミネ工業 |
| CH3COOH調製スチーブンサイト2wt%分散液(pH7) | CH3COOH添加ST2wt%分散液 | 14542 | クニミネ工業 |
| H2SO4調製スチーブンサイト2wt%分散液(pH7) | H2SO4添加ST2wt%分散液 | 14541 | クニミネ工業 |
| ヘクトライト2wt%N-メチルホルムアミド+グリセリン分散液 | SWN2wt%有機分散液 | 14341 14581 14582 |
クニミネ工業 |
| スチーブンサイト2wt%N-メチルホルムアミド+グリセリン分散液 | ST2wt%有機分散液 | 14583 14584 |
クニミネ工業 |
| N-メチルホルムアミド+グリセリン溶媒 | 有機ブランク | 14346 | クニミネ工業 |
| NaHCO3+NaOH(pH10.5)緩衝溶液 | pH10緩衝液 | 14162 | 自作 |
| ヘクトライト粉末 | SWN粉末 | 14022 | クニミネ工業 |
| スチーブンサイト粉末 | ST粉末 | 14024 | クニミネ工業 |
| 5wt%アジピン酸水溶液 | AA水溶液 | - | 自作 |
粘土分散液のイオン量を変えたサンプルのイオン量の参考値を表に示す.
| meq/100g | |||||||
| Ca | Mg | Na | K | Li | 計 | ||
| KP-F | 未処理 | 29.22 | 2.83 | 107.87 | 2.39 | 0.00 | 142.31 |
| イオン増量 | 23.1 | 1.23 | 231.21 | 1.27 | 0.00 | 256.81 | |
| イオン減量 | 28.37 | 2.85 | 103.24 | 2.15 | 0.00 | 136.61 | |
| SA | 未処理 | 1.24 | 49.78 | 108.72 | 1.14 | 0.00 | 160.88 |
| イオン増量 | 1.47 | 41.23 | 185.09 | 0.00 | 0.71 | 228.50 | |
| イオン減量 | 1.73 | 51.47 | 83.15 | 1.02 | 0.00 | 137.37 | |
| ST | 未処理 | 2.7 | 88.88 | 198.43 | 0.88 | 0.00 | 290.89 |
| イオン増量 | 1.73 | 80.06 | 314.46 | 0.00 | 0.00 | 396.25 | |
| イオン減量 | 2.72 | 95.49 | 169.16 | 1.14 | 0.00 | 268.51 | |
| SWN | 未処理 | 3.2 | 58.11 | 111.08 | 1.26 | 0.61 | 174.26 |
| イオン増量 | 3.23 | 43.43 | 156.18 | 1.27 | 44.49 | 248.60 | |
| イオン減量 | 2.47 | 61.93 | 96.94 | 1.01 | 0.51 | 162.86 | |
表に電極に使用した金属を示す.
| 名称 | 略称 | Sample ID | 規格 |
|---|---|---|---|
| アルミニウム4N箔 | アルミニウム箔 | 13932 | 厚み0.1mm,純度99.99% |
| アルミニウム板 | アルミニウム | - | ケニス |
| 亜鉛板 | 亜鉛 | - | ケニス |
| 鉄板 | 鉄 | - | ケニス |
| ニッケル板 | ニッケル | - | ケニス |
| 鉛板 | 鉛 | - | ケニス |
| 銅板 | 銅板 | 14222 | 厚み0.3 mm |
| 金線 | Au | 14587 | Φ0.3,純度99.99% |
| 亜鉛線 | Zn | 14547 | Φ0.5 |
| 銅線 | Cu | - | Φ2 |
| 白金棒 | Pt | 14621 14622 |
Φ1,長さ100 mm |
| グラッシーカーボン棒 | GC | 14496 14497 |
Φ3,長さ100 mm |
10wt%以上の高濃度粘土分散液の作成方法
精製水を入れた10 mLビーカーに上皿電子天秤(西独ザウトリウス社,L420S+,装置ID:622)で量り取った粘土粉末をガラス棒で攪拌させながら少量ずつ入れた.10wt%以上の粘土分散液はガラス棒で搗くように押しつぶしながら混ぜ込み,所定濃度へと調整した.
pH10緩衝液作成方法
JISK80011)のpH10緩衝液の作成法に従った.0.2 Mの水酸化ナトリウム(和光純薬工業,特級,試薬ID:7650)水溶液5.35 mLと0.05 Mの炭酸水素ナトリウム(和光純薬工業,特級,試薬ID:13449)水溶液を50 mLを100 mLフラスコに正確にとり,水を標線まで加えて混合して作成した.
AA水溶液作成方法
白谷の修士論文2)の作成方法に従った.上皿電子天秤(A&D社,EK-300i)でアジピン酸アンモニウム(日本蓄電器工業,コンデンサグレード)10 gを測り取った.200 mLビーカーに純水190 gを測り取った.純水が入ったビーカーに測り取ったアジピン酸アンモニウムを10 g加えた.アジピン酸アンモニウムの白色結晶が目視で観察できなくなるまでガラス棒で攪拌した.
参考文献(後で統合)
- 1)日本工業規格,JISK8001,p69(2017)
- 2)白谷貴明(2019).アノード酸化皮膜に対する対象物接触による絶縁性の発現理論,山形大学院理工学研究科修士論文,p20.
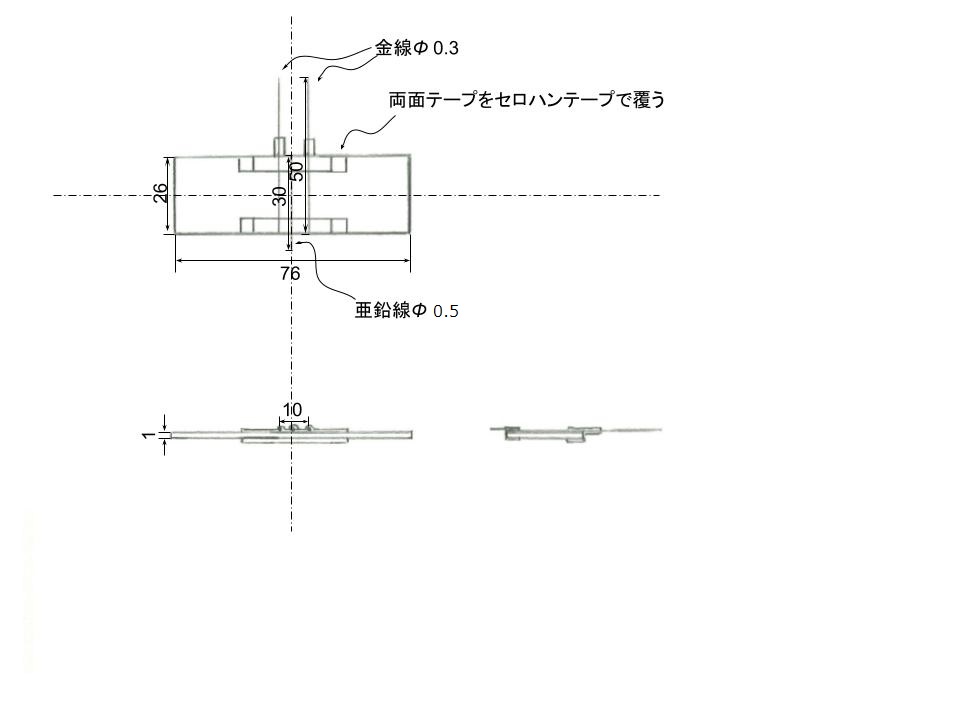
図1にスライドガラスセルの図面を示す.顕微鏡の対物レンズとステージとの間に収まるセルを試作した.セルはスライドガラスにAuの作用極と対極を,電極間距離10 mmで配置した.作用極と対極の中間点に,Znの準参照極を配置した.作用極と対極と参照極に,それぞれ試料を1滴ずつ滴下した.このセルをスライドガラスセルとした.
3.1.2クロノポテンショグラムと顕微鏡観察結果スライドガラスセルで使用したスライドガラスセルの電池式一覧を表に示す.
| 番号 | 電池式 | 備考 |
|---|---|---|
| 1 | Au|ヘクトライト2wt%/水分散液|Zn vs.Zn | - |
| 2 | Au|スチーブンサイト2wt%/水分散液|Zn vs.Zn | - |
| 3 | Au|ヘクトライト2wt%/有機分散液|Zn vs.Zn | - |
| 4 | Cu|ヘクトライト2wt%/水分散液|Cu vs.Cu | - |
| 5 | Cu|ヘクトライト2wt%/水分散液|Cu vs.Cu | - |
| 6 | Au|ヘクトライト2wt%/有機分散液+PP|Au vs.Zn | - |
| 7 | Au|NaHCO3+NaOH緩衝液(pH=10.5)|Au vs.Zn | 溶液がスライドガラスセルからこぼれてしまうため電極の周りにバスボンドで堤を作成 |
| 8 | Au|N-メチルホルムアミド+グリセリン|Au vs.Zn | 溶液がスライドガラスセルからこぼれてしまうため電極の周りにバスボンドで堤を作成 |
| 9 | Au|有機系ブランク+有機系ヘクトライト2滴|Au vs.Zn | 溶液がスライドガラスセルからこぼれてしまうため電極の周りにバスボンドで堤を作成 |
このページに前処理から廃液処理までの一連の流れを載せているので参照してください.
金属の前処理はメッキなどを行う上で重要な工程で研磨や脱脂などのことを指す.斉藤は一般金属材料の表面にはほとんどの場合,油脂,さび,ほこり,ごみなどの汚染物質が付着している.メッキの前処理とは,これらの汚れを金属材料表面から除去し,メッキに最も適した,洗浄な状態にする操作およびその工程をいう.すなわち金属材料表面の汚染物質を除去し,活性化することが前処理を行う目的であり,一般的な化学的方法による前処理工程の順序は,脱脂-水洗-酸洗-水洗-活性化-水洗であると述べられている1).
アルミニウム箔の前処理の説明を行う.10 mLビーカーを8個用意する.6つのビーカーに精製水を1/3入れた.残り2つの10 mLビーカーに1MNaOH水溶液と1MHNO3水溶液をそれぞれ1/3づつ入れたもの用意した.
はじめに,1MNaOH水溶液に60秒浸漬し,精製水に30秒浸漬を3回繰り返して洗浄した.その後1MHNO3水溶液で30秒浸漬し,精製水に10秒浸漬を3回繰り返して洗浄した.前処理後は自然酸化被膜が形成されるためにすぐに実験溶液に浸し実験を開始させた.
4.1.4 アルミニウムのアノード酸化の可能性の実験で使用したアルミニウム箔や3章で使用した金属はすべて前処理を行った.
4.1.3 アルミニウムの表面酸化物除去の可能性で使用したアルミニウム箔の前処理については白谷の修士論文2)によると前処理を行うことでアルミニウム箔上に白い結晶を作り,クロノポテンショグラムが直線にならずに平坦部分ができてしまうと記述していたので前処理の工程を行わず,水洗いのみ行った.
グラッシーカーボンの粗削り
電極表面の粗削り用に#1500の耐水性ペーパーを用意した.精製水で耐水ペーパーを濡らした.耐水ペーパーにグラッシーカーボン電極の底面を置き,耐水ペーパーの上で8の字を書くように軽い力で1分間研磨した.
次に電解液に浸漬するグラッシーカーボンの側面を研磨した.濡らした耐水ペーパーでグラッシーカーボンを包んだ.耐水ペーパーで包んだグラッシーカーボンを軽い力で回転させて1分間研磨した.
最後に100 mLビーカーに入れた精製水にグラッシーカーボンを浸漬させて洗った.
グラッシーカーボンの仕上げ研磨
仕上げ研磨のためにドクターラップのポリシングクロスを用意した.0.05 µmアルミナ懸濁液でポリシングクロスを濡らした.研磨方法は2.1.1グラッシーカーボンの粗削りで記述した方法と同じで行い時間のみ3分間行った.
グラッシーカーボン電極の表面についたアルミナを精製水で洗い流した.最後に100 mLビーカーに入れた精製水にグラッシーカーボンを浸漬させて洗った.
参考文献(後で全体と東郷)
- 1)斉藤いほえ.”めっき前処理技術”,実務表面技術,33(1986),286-293
- 2)白谷貴明(2019).アノード酸化皮膜に対する対象物接触による絶縁性の発現理論,山形大学院理工学研究科修士論文
2.2評価
図に顕微鏡観察の模式図を示す.光学顕微鏡(BX53M, OLYMPUS製)のステージに,偏光子の偏光板を置いた.そこにスライドガラスセルを置き,さらに検光子の偏光板を置き擬似的な偏光顕微鏡として使用した.通電しながらセルの作用極近傍をクロスニコルとオープンニコルで観察した.電流の極性を切り替えて,光学顕微鏡観察を繰り返し行った.
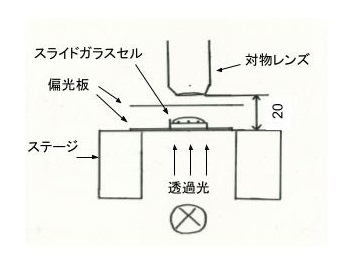
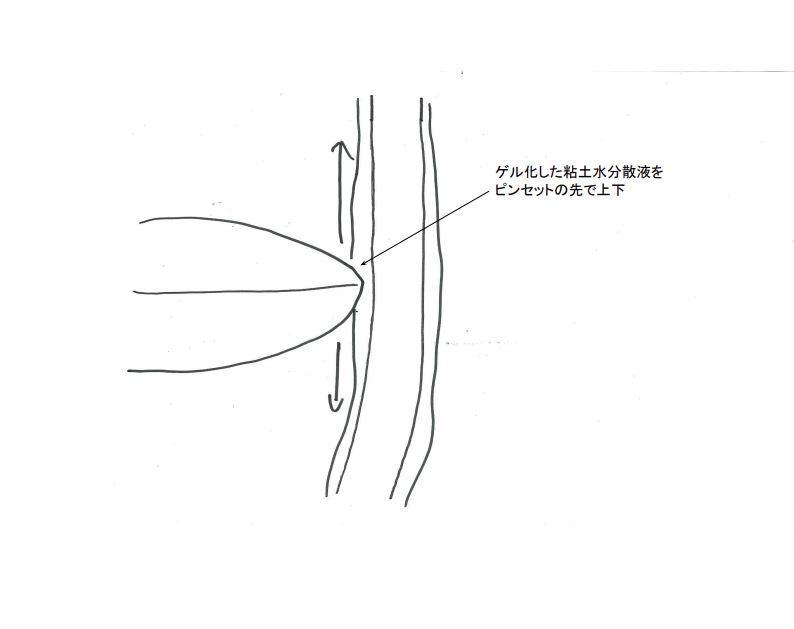
図にゲル化の観察の模式図を示す.顕微鏡下で通電後の粘土分散液のゲル化の観察も行った.電極近傍の粘土分散液をピンセットで突っつき,ゲル化の状態を観察した.
クロノポテンショメトリーのクロノ(chrono-)は時間を表す接頭語であり,ポテンショメトリーは電圧(-potentio-)測定法(-metry).つまり電位の時間変化を測定し電気化学反応に関する様々なパラメータを求める測定法がクロノポテンショメトリーである.一般的に行われているクロノポテンショメトリーは作用極に定電流を流し,作用極と電解液の間に流動を与えない状態で電位の経時変化を測定する.
セルの通電にはガルバノスタット(HA151,北斗電工製)を使った.3.1.2クロノポテンショグラムと顕微鏡観察結果の電流制御は最初電流密度 +100µA/cm2でアノード電流を通電した.330秒経過後,カソード反転し,電流密度-100µA/cm2でカソード電流を通電した.さらに240秒経過後,再アノード反転し,電流密度+100µA/cm2で再びアノード電流を通電した.
その後のクロノポテンショメトリーの電流制御は統一し以下の条件で実験を行った.最初電流密度+100µA/cm2 でアノード電流を通電した.300秒経過後,カソード反転し,電流密度-100µA/cm2 でカソード電流を通電した.さらに300秒経過後,再アノード反転し,電流密度+100µA/cm2 で再びアノード電流を通電した.
電流制御
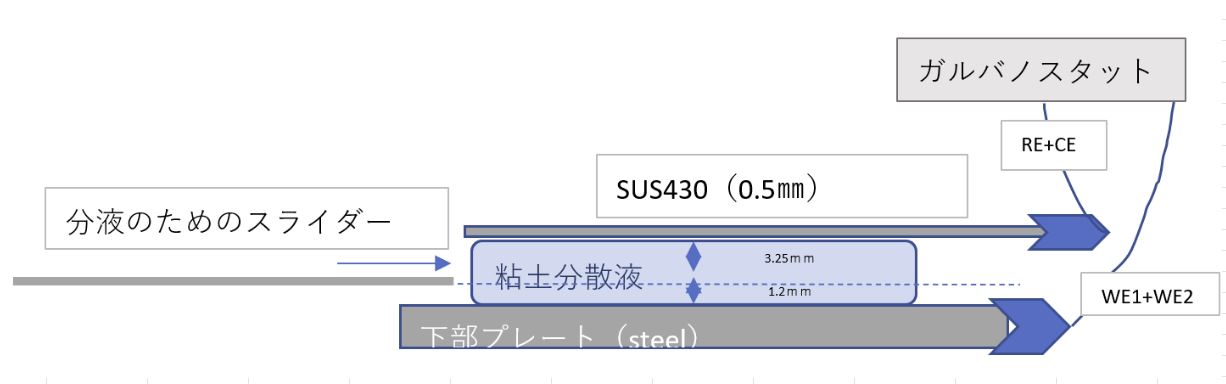
粘弾性測定にはレオメータ(Thermo Fisher Scientific,HAAKE MARSⅢ type066-1322)を使用した.図に3.2.1電界印加と粘弾性の測定時のセルの概略図示す.粘土分散液はSWN2wt%分散液を使用した.レオメータの下部プレートを作用極とし,対極をステンレス板として,下部プレート|SWN2wt%分散液|SUS430のセルを組み立てた.そのセルに2.2.3 クロノポテンショメトリーの条件で通電した.通電後の作用極から1 mmスライダーを差し込み分液した.通電後の作用極に付着したSWN 2wt%/水分散液を電極近傍試料,その周辺のヘクトライト 2wt%/水分散液を沖合試料として,未通電のヘクトライト 2wt%/水分散液と比較した.それぞれの試料で静的粘弾性測定を行い,測定ギャップ50 µmとし,Gapセット後2分静置してから1~1000 /sのup過程でせん断をかけ,そのあとすぐに1000~1 /sのdown過程で粘度を測定した.値はせん断速度1.32 /s時のdown過程を採用した.
3.3.2温度変化による粘土分散液の動的粘弾性と相変化については,動的粘弾性の温度依存性をレオメータ(Thermo Fisher Scientific,HAAKE MARSⅢ type066-1322)で測定した.ST2wt%分散液を使用し,ローター直径60 mmのoパラレルプレートPP60TiL(222-18666)を用いてf=1.0 Hz,ω=6.283 rad/s,γ=0.05の条件で温度依存による貯蔵弾性率G'および損失弾性率G''を測定し,G''/G'としてtanδを得た.
 図
16
.
セルの概略図
図
16
.
セルの概略図
この評価法で3.3相変化とエントロピー変化の関係の実験をした.図にセルの図面を示す. ウォーターバス内を水を満たして温度33 ℃に設定した.棒温度計をウォーターバス内に差し込み温度が33 ℃になるか確認した.100 mLビーカーにスチーブンサイト2wt%/水分散液を液面高さ4 ㎝になるように入れた.銅電極を電極間距離10 mm,電極面積10 ㎜で固定した.これを電池式Cu|スチーブンサイト2wt%/水分散液|Cuの100 mLビーカーセルとした.
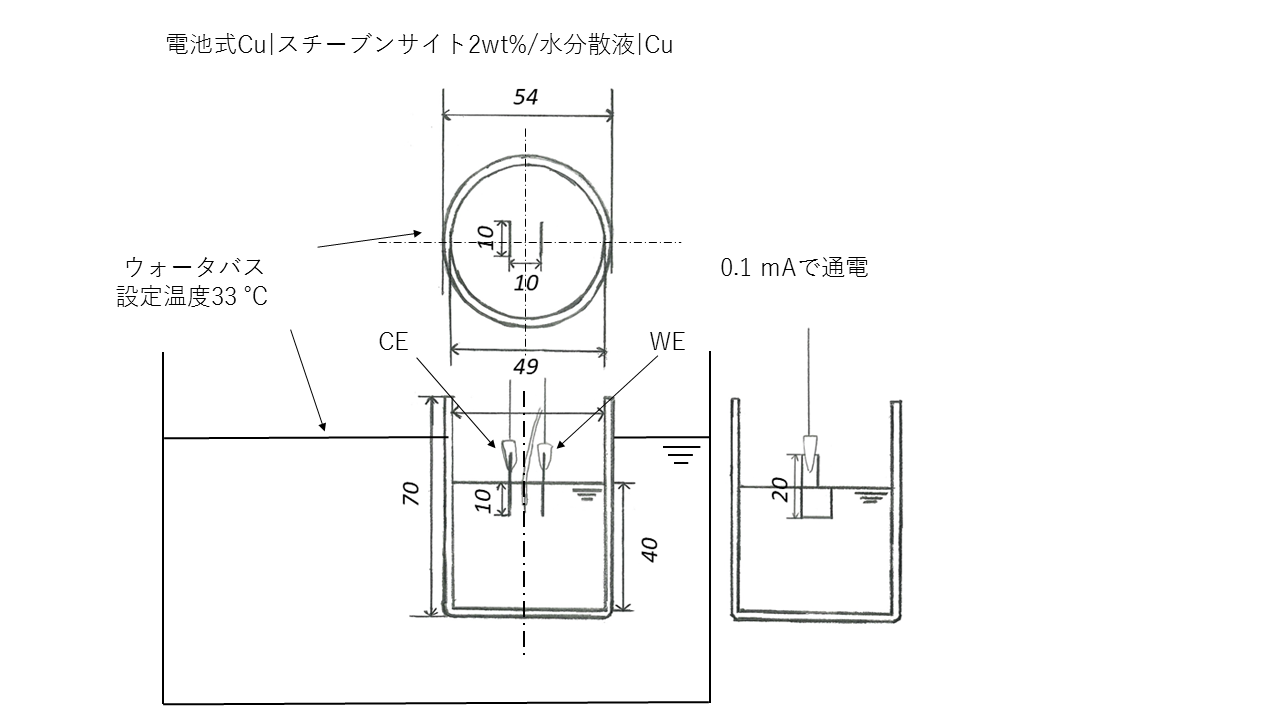
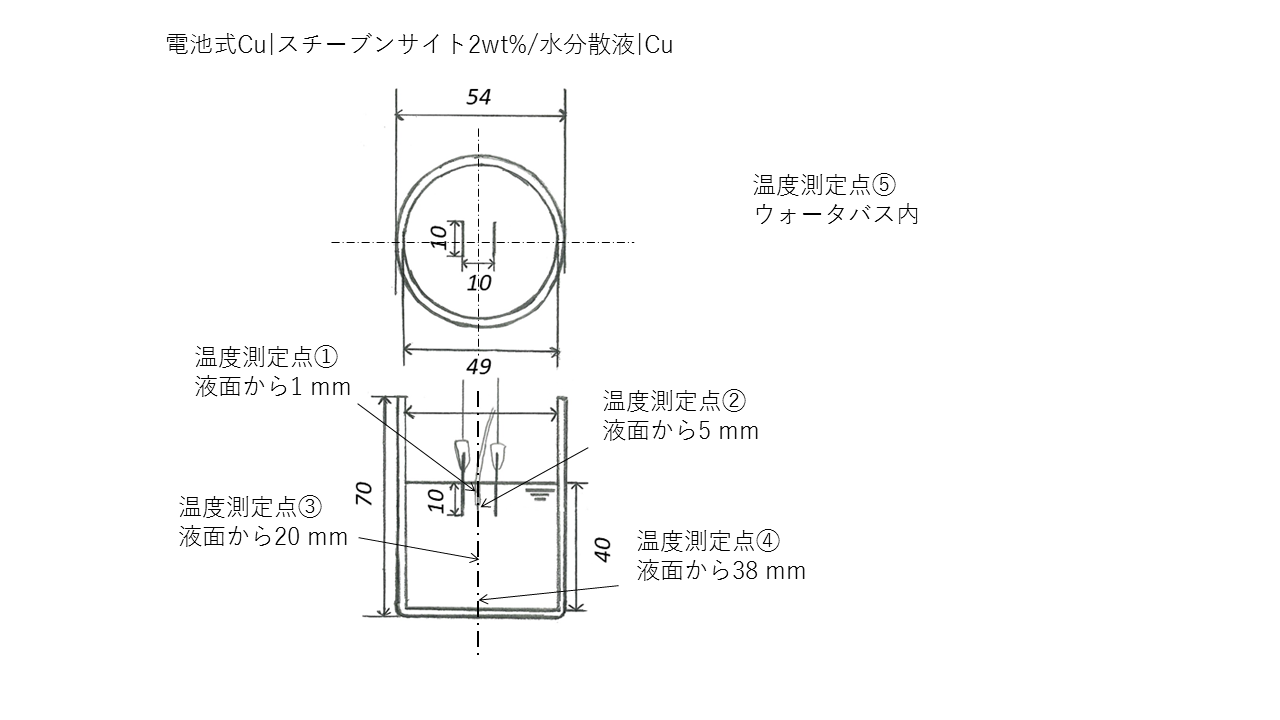
100 mLビーカーセルをウォーターバス内に入れた.ウォーターバス内に100mlビーカーセルを固定するのにc型クランプを使用した.熱電対を使い100 mLビーカーセル内の液温がウォーターバス内の水温と同じになるのを確認した.熱電対を電極間に差し込み,100 mLビーカーセル内で熱電対で温度を測る場所を図のように設定した.①が液面,②液面から1 ㎝,③液面から2.5 ㎝,④が液面から3.8 ㎝とした.100 mLビーカーセル内の②で高さを固定して熱電対を左右に動かしてサーモグラフィーを用いて表面温度も測定した.液温が水温と一定になったらガルバノスタットを用いて見かけの電流密度0.1 mA/cm2で通電した.温度の記録を測定開始時,6分,15分,50分,70分で行った.
漬処理液として,低粘度なpH10緩衝液と高粘度なSWN2wt%分散液を準備した.アルミニウム箔を使用した.
図に電位測定時の概略図を示す.未化成箔への皮膜除去効果を見るために,それぞれの浸漬処理液に,アルミニウム箔を浸漬し,銀塩化銀電極に対する電位Eの時間変化を測定した.同時に電極の様子も観察した.
図に旗型電極の平面図を示す次に化成箔への皮膜除去効果を見るために,アルミニウム箔を,幅10 mm,高さ50 mmで,電解液に浸る面積が,両面で1000 mm2となるように金切りばさみを用いて切り出し旗型電極とした.
図に50 V化成実験セルの図面を示す.図に50 V化成実験の回路図を示す.直流電源(高砂製作所,ZX-S-1600MA)を用いて電流10 mAを通電し,アルミニウム箔をAA水溶液中で,アノード酸化した.みかけの電流密度j=1 mA/cm2 となるようにした.電流絞り込みは行わず,50 Vに到達したらただちに電流をカットオフした.アノード酸化時の電圧Vを時間tとともに記録しクロノポテンショグラムを得た.
浸漬処理は100 mLビーカーにpH10緩衝液または粘土分散液を100 mL入れた.液が入った100 mLビーカー内に50 V化成アルミ箔を電極間距離6 mmとなるようにワニ口クリップで固定して,19時間経過させた.浸漬後に光学顕微鏡で観察した.
図に静電容量測定時の図面を示す.図に静電容量測定時の回路図を示す.静電容量の測定は,浸漬処理した電極をよく水洗いし,浸漬条件と同じ位置に電極を置き,セルを組んだ.このセルの電解液にAA水溶液を入れ,LCRメーター(HIOKI,3522-50)を用いてインピーダンス|Z|と位相角θを測定した.直列等価回路と仮定して,静電容量Csを求めた.
塗工時における化成箔への皮膜除去効果を見るために,地面に対して垂直につるした50 V化成アルミ箔に,浸漬処理液をディスポスポイトで2 mL垂らして塗工処理して19時間静置した.静置した箔の目視観察を行い,AA溶液中でアルミ箔の電位を銀塩化銀電極を用いて測定した.その後,上述の条件で50 Vまで再化成を行った.
現代の電気化学によるとアルミニウムをアノード溶解すると(1)式の反応でアルミニウム表面に酸化物(Al2O3)の強固で緻密な皮膜が生成される.
しかし,水溶液から生成したばかりの酸化アルミニウムは酸に溶けやすいので,一部は(2)式によって化学溶解する.
すなわち,アルミニウムを硫酸中でアノード酸化すると,最初は強固で緻密なバリアー層の酸化皮膜が生成するが,間もなく,生成した皮膜の各所に微細な孔が生じ,その後皮膜の成長はこの孔の底部で起こり,生成した酸化物は横方向に押し出され,上へ上へとのびて,ポーラスな酸化皮膜(ポーラス層)が形成される1).
この評価法で4.1.4 アルミニウムのアノード酸化の可能性の実験をした.図にセルの図面を示す.図に旗型電極の平面図とアノード酸化限界電圧測定時の図面を示す.作用極には,4N のアルミニウム箔を旗形に切り出した電極面積 1 cm2(片面 10×5 mm)の旗形電極を使用した.対極に,SUS容器(コヒーミルクピッチャー,内径 30 mm)を用いていた.
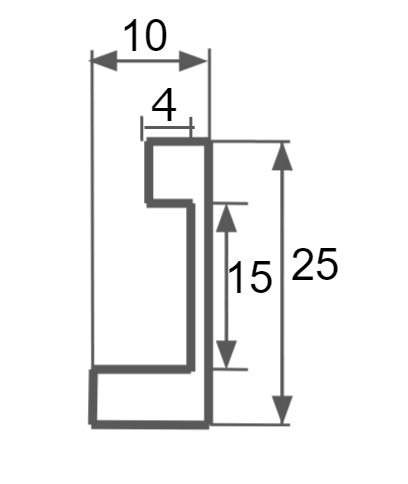
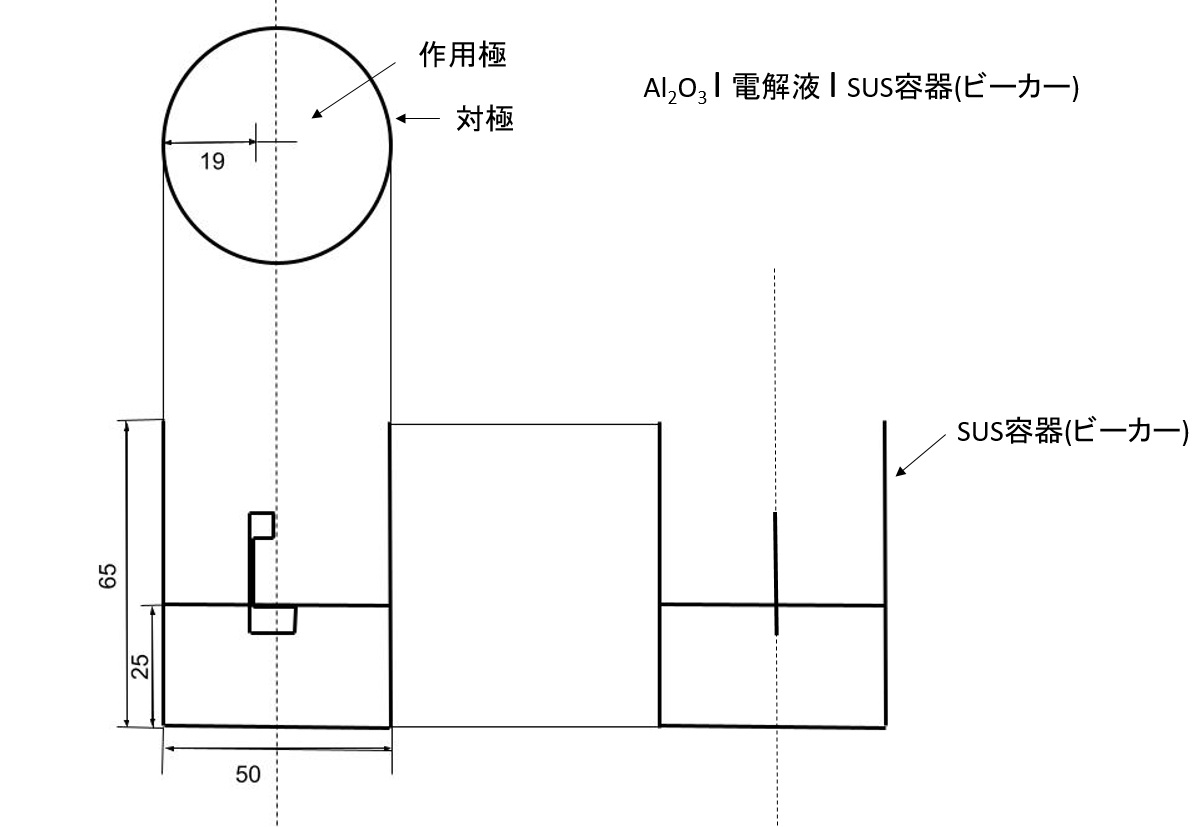
定電流直流電源を用いて山本君の手順(2-3-3)でセルをつないだ.
電流密度1 mA/cm²とし,低圧用化成箔の皮膜耐電圧試験法2)に従って,皮膜耐電圧 Vfと電圧上昇速度 dV/dtを測定しながら試験中の気体の発生や火花の様子を観察した.粘土/水分散液の分散の状態によってアノード酸化限界電圧にばらつきができてしまうためSUSカップは底の浅いコーヒーミルクピッチャーを使用した.
皮膜耐電圧測定後のアルミニウム箔を目視及び光学顕微鏡で観察した.
表に使用したセルの電池式を示す.
| 番号 | 電池式 | 備考 |
|---|---|---|
| 1 | Al(4N)|スチーブンサイト2wt%/水分散液|SUS容器 | - |
| 2 | Al(4N)|ヘクトライト2wt%/水分散液|SUS容器 | - |
| 3 | Al(4N)サポナイト2wt%/水分散液|SUS容器 | - |
| 4 | Al(4N)|NaOH+NaHCO3水溶液|SUS容器 | - |
参考文献(後で全体と東郷)
- 小沢昭弥.”現代の電気化学”,新星社,1990,pp149-150
- 2)永田伊佐也.”電解液陰極アルミニウム電解コンデンサ”,日本蓄電器工業株式会社,1997.p621
2.2.8 導電率評価法
交流インピーダンス法
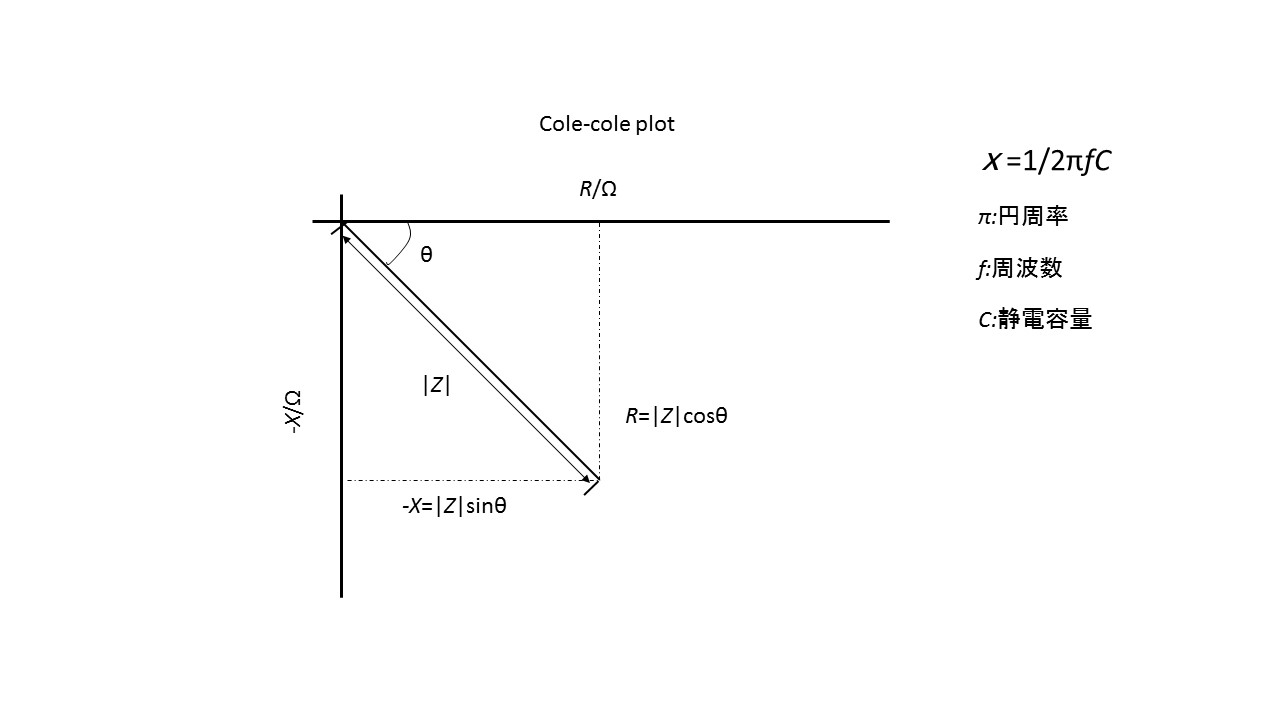
交流インピーダンス法は電極界面のインピーダンスを測定する手法である.図にcole-cole plotを示す.cole-cole plotは複素インピーダンス|Z|と位相角θを極座標平面にプロットすることで得られる.複素インピーダンス|Z|は交流を印加した時の電圧の振幅を電流の振幅で割った物理量で,位相角θは電圧と電流の波形のずれである.cole-cole plotは特性上周波数の情報が消えてしまうためプロット上に周波数を書き込む必要がある.
交流インピーダンス法によりイオン導電率を求める方法は小林らの論文に書かれているものを要約する1).周波数応答解析装置を使い測定条件として交流印加電圧は,10 mVから1 V程度の範囲で設定する.一般的には10 mV程度に設定することが推奨されるが抵抗値が高く,インピーダンス|Z|が数100 kΩを上回るような場合は電流がわずかにしか流れず,測定誤差が大きくなるため,振幅を1 V程度にする必要がある.逆のことをを考えるとインピーダンス|Z|が数10 Ωを下回る場合は,電流が過剰に流れるため測定誤差が大きくなる場合があるので必要に応じて印加電圧の振幅を小さくする必要がある.一般に測定の周波数範囲は,1 mHz-1 MHzに設定するがインダクタンスによる影響が考えられるので正確な導電率を求めるためには10 MHzまで測定することを推奨する.本論文では3章,4章でセル定数を求めるために使い,4章で導電率を求めるために使用した.
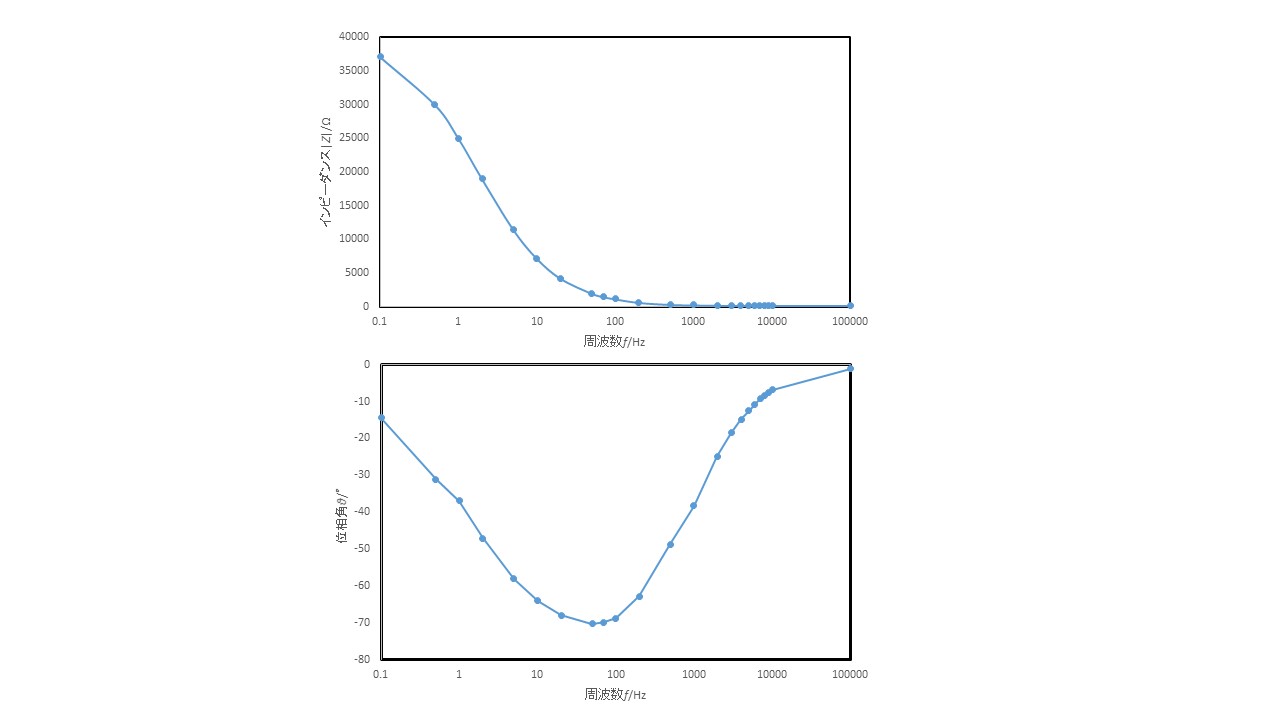
図にBode plotを示す.周波数特性を見るにはBode plotの方が見やすいのでそちらの図を描くことを推奨する.Bode plotは縦軸に|Z|,と位相角θ横軸に周波数fをプロットすることで得られる.
セル定数の決定
セル定数は交流インピーダンス法で求めた.セル定数を求めるために電解液にはあらかじめ導電率が分かったもの,例えば0.02 MKCl水溶液(25 ℃,2.8 mS cm-1),1 MKC水溶液(25 ℃,100 mS cm-1)2)を使い5 kHz時のRACRを使い(1)式より求めた.
導電率測定
溶液の導電率は卓上型の電気伝導率計(TOADKK,CM-40G,装置ID:444)とハンディタイプの電気伝導率計LAQUAtwin(HORIBA,EC-33B,装置ID:ID:1897)を使用した.また粘土分散液の濃度が高く市販の電気伝導率計で測定できないものはLCRハイテスタ(HIOKI,3522-50,装置ID:846)を使い,交流インピーダンス測定測定により求めた.測定条件は小林らの論文1)を参考にした.図にセルの三面図を示す.電極には一般的には白金黒電極などを用いるのが好ましいが本研究では白金で代用した.測定時のLevel(交流印加電圧)は10 mV,周波数範囲は1 Hz-100 kHzとした.導電率σ/S cm-1を求める際の周波数は5 kHzのインピーダンス|Z|/Ωと位相角θ/°を使い(2)式からR/Ωを算出した.算出した交流抵抗RACRとセル定数a/cm-1から(3)式を用いて導電率σ/S cm-1を求めた.同じセルを使い10 µAの定電流をガルバノスタット(HOKUTO DENKO,HA-151,装置ID:171)で通電し,IRジャンプした際の電圧から開回路電圧の差から求めたΔE/Vから(4)式を使い直流抵抗RDCRを求めた.(5)式から直流の導電率を求めた.

表に実験で使用した4.2粘土/水分散液の導電率で使用した電池式一覧を示す.
| 番号 | 電池式 | 備考 |
|---|---|---|
| 1 | Pt|0.02 MKCl|Pt | セル定数の決定に使用 |
| 2 | Pt|ST20wt%分散液|Pt | - |
| 3 | Pt|ST30wt%分散液|Pt | - |
| 4 | Pt|ST35wt%分散液|Pt | - |
| 5 | Pt|ST40wt%分散液|Pt | - |
| 6 | Pt|ST45wt%分散液|Pt | - |
| 7 | Pt|ST50wt%分散液|Pt | - |
| 8 | Pt|SWN30wt%分散液|Pt | - |
| 9 | Pt|SWN40wt%分散液|Pt | - |
| 10 | Pt|SWN50wt%分散液|Pt | - |
参考文献
- 1)小林 玄器, 佐藤 祐一,”第3回 固体電解質,全固体二次電池の基礎と評価法”,Electrochemistry,82 巻 ,12 号(2014),pp1108-1113
- 2)藤嶋昭,相澤益男,井上徹,”電気化学測定法 上”,技報堂出版株式会社,2010,p42
3.粘土分散液の電界応答としてのレオロジーと液晶性
3.1電界印加と複屈折性
3.1.1作成したセルの使用感
図に作成したスライドガラスセルを用いて顕微鏡観察を行った際の様子を示す.顕微鏡観察するうえで,作成したスライドガラスセルは,粘度が高く,透明な溶液の観察に適していた.特に,粘土/水分散液は,よく観察できた.
pH10の緩衝液ではスライドガラスからこぼれてしまい観察はできなかった.また透明でない溶液も観察出来なかった.
 図
30
.
スライドガラスセルの使用感
図
30
.
スライドガラスセルの使用感
3.1.2クロノポテンショグラムと顕微鏡観察結果
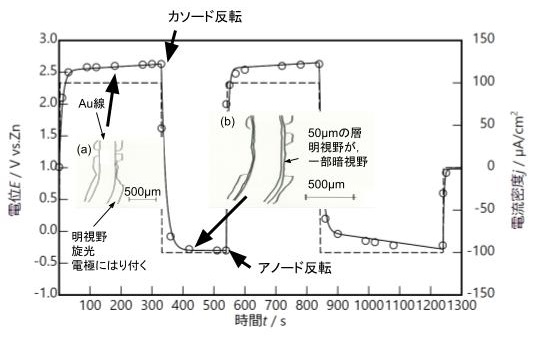
図にクロノポテンショグラムと顕微鏡観察結果を示す.通電前の亜鉛に対する自然電位は1.0Vだった.通電開始10秒で 2.1V,30秒で2.5Vまで電位が上昇した.
図の(a)に電極近傍の顕微鏡観察結果を示す.金電極表面から沖合500µm付近のヘクトライト2wt%/水分散液が旋光し明視野が観察さた.金電極表面にヘクトライト2wt%/水分散液がはり付いた.この金電極表面から沖合500 µmの旋光しているヘクトライト2wt%/水分散液の層を田邉-伊藤層500と名付けた.
カソード反転後,330 秒で電位が1.6Vになり340秒で0.8V,350秒で0Vとなった.430秒で電位は-0.3Vになった.図の(b)に電極近傍の顕微鏡観察結果を示す.カソード反転前に旋光し明視野が観察されていたところが一部暗視野になった.また金電極表面にオープンニコルでも観察できる,厚み50 µmの層が観察された.この金電極表面に生成する50 µmの層を田邉-伊藤層50と名付けた.
再アノード反転後,540 秒で電位が2Vとなり,550 秒で2.3V,590秒で2.5Vとなった.640秒で電位が2.6Vだった.再アノード反転前に観察された田邉-伊藤層50が消えた.図の(a)同様に田邉-伊藤層500が観察されました.



図に田邉伊藤層50のゲル化の観察結果を示す.カソード分極時に生成した田邉-伊藤層50は周りのヘクトライト2wt%/水分散液より固く,ピンセットを差し込む上下することで層が崩れた.崩れた層はピンセットでつまめるくらいゲル化しており,固まったヨーグルトぐらいの固さであった.
アノード分極後ゲル化したヘクトライト2wt%/水分散液が電極にはり付いてた.ピンセットを差し込み上下しても周りのヘクトライト2wt%/水分散液との違いは分かららなかった.

表に通電による田邉-伊藤層の生成条件をまとめた.田邉-伊藤層50はカソード分極のみでは生成することはなく,カソード分極前にアノード分極をしていないと発生しなかった.
| 実験開始時の極性 | アノードスタート |
カソードスタート |
||
|---|---|---|---|---|
| 田邉-伊藤層50 | 田邉-伊藤層500 | 田邉-伊藤層50 | 田邉-伊藤層500 | |
| 分極前 | × | × | × | × |
| 0~330 s | × | ○ 100sほどで旋光し明視野が広がった |
× | ○ 金電極の周りがぼやけていた |
| 極性切り替え 330~540 s |
○ 極性切り替え後100sほどで観察 |
○ 極性切り替え前明視野だったところが暗視野になった |
× | ○ 旋光して明視野が広がった |
| 極性切り替え 540~840 s |
× 極性切り替え後100sほどで消滅 |
○ 明視野が広がった |
○ 100s程で観察された |
○ 明視野が暗視野になった.TIL50の中に泡が発生して移動していた |
| 極性切り替え 840~1080 s |
○ 極性切り替え後100sほどで生成 |
○ 明視野から暗視野になった |
× 極性切り替え後100sほどで消滅 |
○ 明視野が広がった |
表にセルの違いによる田邉-伊藤層50の生成条件をまとめた.スチーブンサイト2wt%/水分散液でも田邉-伊藤層50は生成した.ブランクのNaOH-NaHCO3緩衝液では田邉-伊藤層50の生成は確認できなかった.
田邉-伊藤層50は電極を銅に変えた場合や-1.6 Vの電圧を印加した時は,アノード反転しても消えずに残った.また銅電極がアノード分極時に溶け出して粘土分散液が一部青くなっていたのが確認された.
アノード分極した際に発生する気泡はフェノールフタレイン溶液が無色になったのでpHが下がったので酸素が発生したと考えられる.酸素が発生する際の反応式を(1)に示す.カソード分極時にはフェノールフタレイン溶液の色に変化がないのでpHは塩基性から変化しなかった.発生した気体は水素と考えられる.水素が発生する際の反応式を(2)に示す.
| 電池式 | 田邉伊藤層50 | 泡 | ||||||
| ①カソード分極 | ②アノード分極 | ③カソード分極 | ④アノード分極 | ①カソード分極 | ②アノード分極 | ③カソード分極 | ④アノード分極 | |
| Au|ヘクトライト2wt%/水分散液|Zn vs.Zn | なし | なし | 生成 | 消える | 発生 | 発生 | 発生 | 発生 |
| Au|スチーブンサイト2wt%/水分散液|Zn vs.Zn | なし | なし | 生成 | 消える | 発生 | 発生 | 発生 | 発生 |
| Au|ヘクトライト2wt%/有機分散液|Zn vs.Zn | 生成 | 消える | 生成 | 消える | 発生 | なし | 発生 | なし |
| Cu|ヘクトライト2wt%/水分散液|Cu vs.Cu | なし | なし | 生成 | 残る | 発生 | なし (銅溶出) |
発生 | なし |
| Au|ヘクトライト2wt%/水分散液+PP|Au vs.Zn | なし | なし | 生成 | 消える フェノールフタレイン薄くなるpH酸性 |
発生 | 発生 | 発生 | 発生 |
| Au|ヘクトライト2wt%/有機分散液+PP|Au vs.Zn | 生成 | 消える | 生成 ガスの周りのフェノールフタレイン紫色にpH塩基性,元のpH9 |
消える | 発生 | なし | 発生 | なし |
| Au|NaHCO3+NaOH緩衝液(pH=10.5)|Au vs.Zn | なし | なし | なし | なし | 発生 | 発生 | 発生 | 発生 |
| Au|N-メチルホルムアミド+グリセリン|Au vs.Zn | なし | なし | なし | なし | なし | なし | なし | なし |
| Au|有機系ブランク+有機系ヘクトライト2滴|Au vs.Zn | 生成 | 消える (-1.6V印加し泡を大量に発生させた場合はポラリティを変えても田邉伊藤層50は残る) |
生成 | 消える | あり | なし | あり | なし |
田邉伊藤層は粘土分散液特有の現象であり,アノード分極することで配向に伴う層が生成し,カソード分極時には配向していた粘土シートが凝集し等方的な層になる.またカソード分極時に生成された層はアノード反転することで消える.しかし電極を銅などに変えることで電極自体がアノード反応によってカチオンとして溶け出し粘土分散液と反応することで消えずに残ることが分かった.
3.1.3粘土分散液中の夾雑イオンが及ぼす田邉-伊藤層生成への影響
表に夾雑イオン量を変えた粘土分散液での田邉-伊藤層50生成の影響をまとめたものを示す.イオン増量品はカソード分極前にアノード分極を行わないでも田邉-伊藤層50が生成した.アノード反転することで通常品の同様に層が消えた.イオン減量品は田邉-伊藤層50が生成しなかった.アノード分極時に生成する田邉-伊藤層500は夾雑イオン量による影響はなくどのサンプルでも生成した.
| 分極の操作 | ヘクトライト2wt%/水分散液 | イオン増量ヘクトライト2wt%/水分散液 | イオン低減ヘクトライト2wt%/水分散液 |
|---|---|---|---|
| カソード電流通電 | 層できない | 層できる | 層できない |
| アノード反転 | 層できない | 層消える | 層できない |
| カソード反転 | 層できる | 層できる | 層できない |
| アノード反転 | 層消える | 層消える | 層できない |
アノード分極時に粘土分散液の層間イオンであるNa+がH+に置換されることが報告されている1).このことを踏まえてアノード反応を式(3-1)から(3-3)に示す.(3-2)に示した金の酸化反応時のH+が層間のNa+と置換し,粘土分散液中の層間外のNa+が増えていると考えられる.粘土分散液中のNa+が増えた状態でカソード分極することで田邉-伊藤層50が生成すると考える.イオン増量品はアノード分極する前から粘土分散液中のNa+が豊富にあるためカソード分極のみで田邉-伊藤層50が生成する.イオン低減品はNa+が少ないので田邉-伊藤層50が生成しない.つまり田邉-伊藤層50の生成には夾雑イオン量が影響するが,田邉-伊藤層500の生成は夾雑イオン量によらない.
2Au+3H2O=Au2O3+6H++6e E0=1.457-0.0591pH (3-2)
Na+-粘土シート+H+→H+-粘土シート+Na+(3-3)
カソード分極時に生成する電極近傍のゲル層は,単一の粘土ファイバー(一次構造)からなるとすれば,自己組織化単分子膜のようになっており図のように粘土ファイバーがカチオンを介して固定される凝集状態のようになっていると考えられる.アノード分極時に生成する電極近傍のゲル層は,配向によってゲル化している.バルクの粘土分散液は図のように粘土シートで形成されたファイバーが,トポロジカルに絡み合って固定されゲル化している.


参考文献(あとで全体と統合)
3.2電界印加と粘弾性
3.2.1電界印加と粘弾性
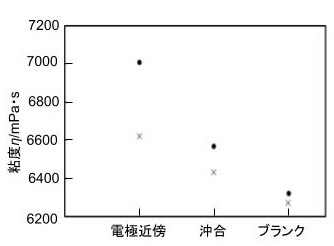
図に電界印加後のSWN2wt%/水分散液のせん断速度1.32 /s時の粘弾性測定の結果を示す.電極近傍試料の粘度が最も高く6800 mPa・sとなり沖合試料6500 mPa・s,ブランクの試料が6300 mPa・sとなった.分極によって粘土分散液がゲル化することで粘性が増し,カソード分極時にできる層の方の粘度が最も高くなることが分かった.
 図
38
.
電界印加と粘弾性の関係
図
38
.
電界印加と粘弾性の関係
3.3相変化とエントロピー変化の関係
3.3.1通電時の温度変化
図に測定時間ごとの温度変化を示す.⑤はウォータバス内の温度なので33℃で一定だった.①は始め30℃だったが400秒で1℃上がった.その後は実験終了時までに温度が緩やかに低下して最終的に30.8℃となった.②が一番温度低下が確認された.実験開始時は31.5℃だったが400秒で31.1℃となった.その後実験終了までに緩やかに温度が低下していって最終的に30.8℃だった.③は始め32℃だったが400秒後には32.2℃になった.その後3000秒後までに0.1度上がって32.3℃となり,その後温度は低下して実験終了時の4200秒後には31.6℃となった.④は始め32.6℃でしたが400秒後には32.9℃になった.その後は緩やかに温度が上昇していて3000秒後には32.8℃だった.最終的には32.6℃となり始めの温度と同じだった.
電極から離れた場所のsスチーブンサイト2wt%/水分散液ほど温度低下が起こりずらくなった.温度は低下し続けることはなく,ある一定の温度となったらその温度を保つような挙動だった.
図にサーモグラフィーでの温度変化の観察を示す.サーモグラフィーでも同様に温度の低下が観察された.測定開始時は31.4 度だったのが70分後は30.7 ℃になった.0.7 ケルビンの温度変化がサーモグラフィーでも観察された.
図に実験終了時の電極の写真を示す.右がアノードで左がカソードとなっている.最終的な通電による粘土/水分散液の相変化はアノード,カソード両極とも2.5 mm生じた.アノード側はゲル化しており最初のスチーブンサイト2wt%/水分散液より粘性が増していた.カソード側では粘土/水分散液がさらさらになり水っぽくなり粘性が下がっていた.
アノード側はスチーブンサイト2wt%/水分散液が電極のエッジ付近に青くゲル状になってはり付いていた. ゲル化していない部分のスチーブンサイト2wt%/分散液は,色が無色透明で変化はしていなかった.銅電極が電解によって銅イオンが溶出し,溶出部分のみがゲル化した.
電解操作により,アノード電極近傍では粘土/水分散液がゲル化した.カソード電極近傍では,粘性が低下しサラサラになった. 電極から遠い所の粘土分散液とで三つの相が生じた.
番温度変化が大きかった測定点②の温度変化は0分から70分の間のΔT=0.7 K, 粘土/水分散液の密度ρ=1.02 g/cm3,比熱c=3.9 J/(g・K),電極面積A=1 cm2,通電により相変化が起きた粘土/水分散液の厚みt=0.5 cm,電極面積と層の厚みから相変化が起きた粘土/水分散液の体積は0.5 cm3,密度から相変化した粘土/水分散液の質量を求めると0.51 g,求めた質量とΔTを比熱にかけて熱量を求めると1.4 Jとなる.0分と70分の平均温度を求めると304.3 Kとなる.求めた数値を使ってエントロピー変化を求めると 4.6 mJ/Kとなる
図に電界印加によって電極に配向する粘土シートのイメージ図を示す.電界の印加によってラメラ配向して分散している粘土シートが,電極に平行に配向する際に粘土シートが乱れてしまう.さらに電極近傍の配向している粘土シートが増えることでほかの粘土シートの自由度が回復しエントロピーが増加してしまう.電界印加によって熱量効果が起こることで吸熱し温度が低下すると考えられる.
3.3.2通電時の電圧変化と温度変化
図にクロノポテンショグラムを示す.セルに0.1mAの定電流を印加すると,電圧は0.1秒以内に0.006Vの開回路電圧から0.4Vへと上昇した.20秒で最大の電圧で1.5 Vになりその後は電圧は減少し,180秒で1.1 Vになった.
図にクロノポテンショグラムと温度変化のグラフを示す.右の軸が実線で示した電圧で左の軸が破線で示した温度となっている.200秒で電圧1.1 Vになったところで電極近傍の粘土/水分散液の相変化が確認された.温度も0.5 ℃減少した.900秒にかけてアノード電極の銅が溶出しているのが確認され電圧は上昇し,1.4 Vとなった.その間温度変化は無かった.その後は電圧も温度減少し実験終了時の4200秒で電圧は1 Vとなった.温度は0.7 ℃下がった.
図にCu|スチーブンサイト2wt%/水分散液|Cu vs.Cuの電位プロファイルを示す.電位プロファイルから求めたバルクの導電率は1.1 mS/㎝となり導電率計で求めた導電率より低くなり,導電率から予見される電位勾配より大きくなった.アノード電極近傍では粘土/水分散液がゲル化し,カソード電極近傍ではサラサラになり粘度が減少した.電極近傍で相変化が起きたことで,電位勾配が大きくなった.この現象はアノードの方が大きかった.
3.3.2温度変化による粘土分散液の動的粘弾性と相変化
図に温度を変化させたときの動的粘弾性のtanδと偏光観察法による振ったときの旋光のしやすさを示す.60℃付近で粘土/水分散液の液晶ゲルとしての相変化が見られ,等方相へ相変化している.温度変化させることで粘土分散液にいくつかの相状態があることがわかった.60℃で振った時に最も旋光しやすく,旋光の余韻が長い.90℃から旋光しづらくなり100℃で旋光しなくなった.
4.粘土分散液のエネルギーデバイスへの応用可能性
粘土材料の液晶化による電気配向現象におけるエネルギーデバイスとしての可能性4.1粘土/水分散液の金属酸化皮膜の除去剤の可能性
4.1.1 各種金属板に対する粘土/水分散液浸漬の目視観察
図1に浸漬開始から6日後の各種金属板に対する粘土/水分散液浸漬実験中の写真を示す.アルミニウムはモンモリロナイト2wt%/水分散液とヘクトライト2wt%/水分散液で変化が起きた.図1(a)に示すようにモンモリロナイト2wt%/水分散液中では白色のゲルが発生した.スチーブンサイト2wt%/水分散液では変化が起こらなかった.ヘクトライト2wt%/水分散液中では多量の泡と白色のゲルが発生した.ヘクトライト2wt%/水分散液中で発生する泡は浸漬開始から20分で白色のゲルと共に発生した.
鉄は全ての粘土/水分散液中で変化が起きた.図1(b)に示すようにモンモリロナイト2wt%/水分散液中では浸漬させていた金属板の全面に茶褐色と緑色のゲルが発生した.スチーブンサイト2wt%/水分散液中では気-液界面の部分的に茶褐色ゲルが発生した.ヘクトライト2wt%/水分散液中では金属板下部に茶褐色と緑色のゲルが発生した.
亜鉛は全ての粘土/水分散液中で変化が起きた.図1(c)に示すようにモンモリロナイト2wt%/水分散液中では白色のゲルが金属板上前面に発生した.スチーブンサイト2wt%/水分散液とヘクトライト2wt%/水分散液中では,部分的に白色ゲルが発生した.
銅はいずれの粘土/水分散液中で変化が起きなかった.同様にニッケル,鉛でも変化は起きなかった.
表1に各種金属板に対する粘土/水分散液浸漬実験の目視観察の様子を示す.モンモリロナイト2wt%/水分散液ではゲルが発生する場合は金属板上の全面に発生し,金属板の面に垂直に成長した.アルミニウムは3種の粘土/水分散液中で変化の様子が異なる結果となった.ヘクトライト2wt%/水分散液でのみ多量の泡が発生した.標準電極電位でニッケルより貴の電位を持つものは反応が起こらなかった.
| 金属種 | SWN2wt%分散液 | ST2wt%分散液 | KPF2wt%分散液 |
|---|---|---|---|
| アルミニウム | 多量の泡 | 変化なし | 全面に白色ゲル |
| 亜鉛 | 部分的に白色ゲル | 部分的に白色ゲル | 全面白色ゲル |
| 鉄 | 部分的に茶褐色ゲル | 部分的に茶褐色ゲル | 全面に茶褐色ゲル |
| ニッケル | 変化なし | 変化なし | 変化なし |
| 鉛 | 変化なし | 変化なし | 変化なし |
| 銅 | 変化なし | 変化なし | 変化なし |
表に各種金属板に対する粘土/水分散液浸漬実験の目視観察の様子を示す.
| 金属種 | SWN2wt%分散液 | ST2wt%分散液 | SA2wt%分散液 | KPF2wt%/水分散液 | pH10緩衝液 |
|---|---|---|---|---|---|
| アルミニウム | 気泡,白い斑点 | 変化なし | 全面こげ茶色,一部に白い粉付着 | 全面黒変,一部白い粉付着,KPF分散液がゲル化して表面に付着 | 全面こげ茶色,孔 |
| 亜鉛 | 部分的に白色ゲル,ゲルの下の地金に黒点 | 部分的に白色ゲル | 全面白色ゲル | 全面白色ゲル,KPFが沈殿 | 表面に垂れるように白色ゲル |
| 鉄 | 部分的に黒緑色ゲルとオレンジゲル | 変化なし | 黒緑色ゲルとオレンジゲル | 黒緑色ゲルとオレンジゲル,KPF分散液が沈殿 | 変化なし |
| チタン | 変化なし | 変化なし | 変化なし | 変化なし | 変化なし |
| 銅 | 表面うっすら緑色 | 表面うっすら緑色 | 表面うっすら緑色 | 気液界面黒変,全体に白濁したゲル | 変化なし |
図にアルミニウムを浸漬実験をした際の電位の時間変化のグラフを示す.浸漬を開始すると電位が下がりだし,3分で電位が最も低くなった.その後は徐々に電位が高くなった.最終的にSWN2wt%分散液の電位が最も低くなり-1.32 Vだった.ST,KPF2wt%分散液は-1.27 Vだった.SA2wt%分散液は-1.22 Vであった.pH10の緩衝液では-1.12 Vで最も高い電位となった.
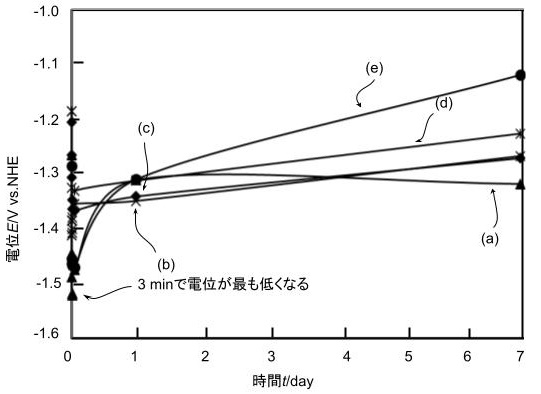
浸漬開始とともにアルミニウム表面の酸化皮膜がpHにより溶け地金が露出することで電位が一旦下がるが,再度皮膜ができることにより電位が上昇していると考えられる.pH10の緩衝液ではその傾向がみられているが,粘土分散液ではpH10緩衝液ほど電位が上昇せずに-1.2~-1.3 Vの電位を保持している.つまり皮膜の成長を阻害するようなものがアルミニウム表面で生成していると考えられ,粘土分散液中の電位変化の挙動はpHだけで説明がつかない.
図2に粘土/水分散液から金属板を引き抜いた際の様子を示す.成長したゲルは金属板にはり付いていた.

図3に浸漬実験後の金属板の写真を示す.図3(a)に示しているようにアルミニウムはモンモリロナイト2wt%/水分散液とヘクトライト2wt%/水分散液に浸漬することで変化が起きた.モンモリロナイト2wt%/水分散液に浸漬していたものは白色層が出来ており,厚みが初めより0.15 mm増加した.ヘクトライト2wt%/水分散液に浸漬していたものは白色層が出来ており,厚みが0.03 mm増加した.スチーブンサイト2wt%/水分散液に浸漬していたものは変化が見られなかった.
図3(b)に浸漬実験後の鉄板の様子を示す.鉄板では全ての粘土/水分散液中に浸漬することで変化が起きた.茶褐色のゲルが付着していた部分の金属光沢が焼失した.厚みに変化はなかった.
図3(c)に浸漬実験後の亜鉛板の様子を示す.亜鉛板では全ての粘土/水分散液中に浸漬することで変化が起きた.白色のゲルが付着していた部分が黒変していた.厚みに変化はなかった.
表2に浸漬実験後の金属板の様子を示す.スチーブンサイト2wt%/水分散液に浸漬したアルミニウムの変化が見られなかった.モンモリロナイト2wt%/水分散液とヘクトライト2wt%/水分散液中に浸漬したアルミニウムは,白色層が付着し厚みが増加した.亜鉛と鉄はゲル化したものが付着した部分の金属表面に変化が起きた.標準電極電位でニッケルより貴の電位をもつ金属では変化は起きなかった.
| 金属種 | SWN2wt%分散液 | ST2wt%分散液 | KPF2wt%分散液 |
|---|---|---|---|
| アルミニウム | 白色層付着厚み0.03mm増加 | 変化なし | 白色層付着.厚み0.15mm増加 |
| 亜鉛 | 白色ゲル付着部分が黒変 | 白色ゲル付着部分が黒変 | 白色ゲル付着部分が黒変 |
| 鉄 | 茶褐色ゲル付着部分の金属光沢消失 | 茶褐色ゲル付着部分の金属光沢消失 | 茶褐色ゲル付着部分の金属光沢消失 |
| ニッケル | 変化なし | 変化なし | 変化なし |
| 鉛 | 変化なし | 変化なし | 変化なし |
| 銅 | 変化なし | 変化なし | 変化なし |
標準電極電位でニッケルより貴の電位をもつ金属では変化は起きなかった.スチーブンサイト2wt%/水分散液中のアルミニウムはpHによる腐食が起きずに酸化皮膜がある状態または金属の地金として保護されている可能性が高い.
4.1.2 アルミニウムに対する粘土/水分散液浸漬による電位変化
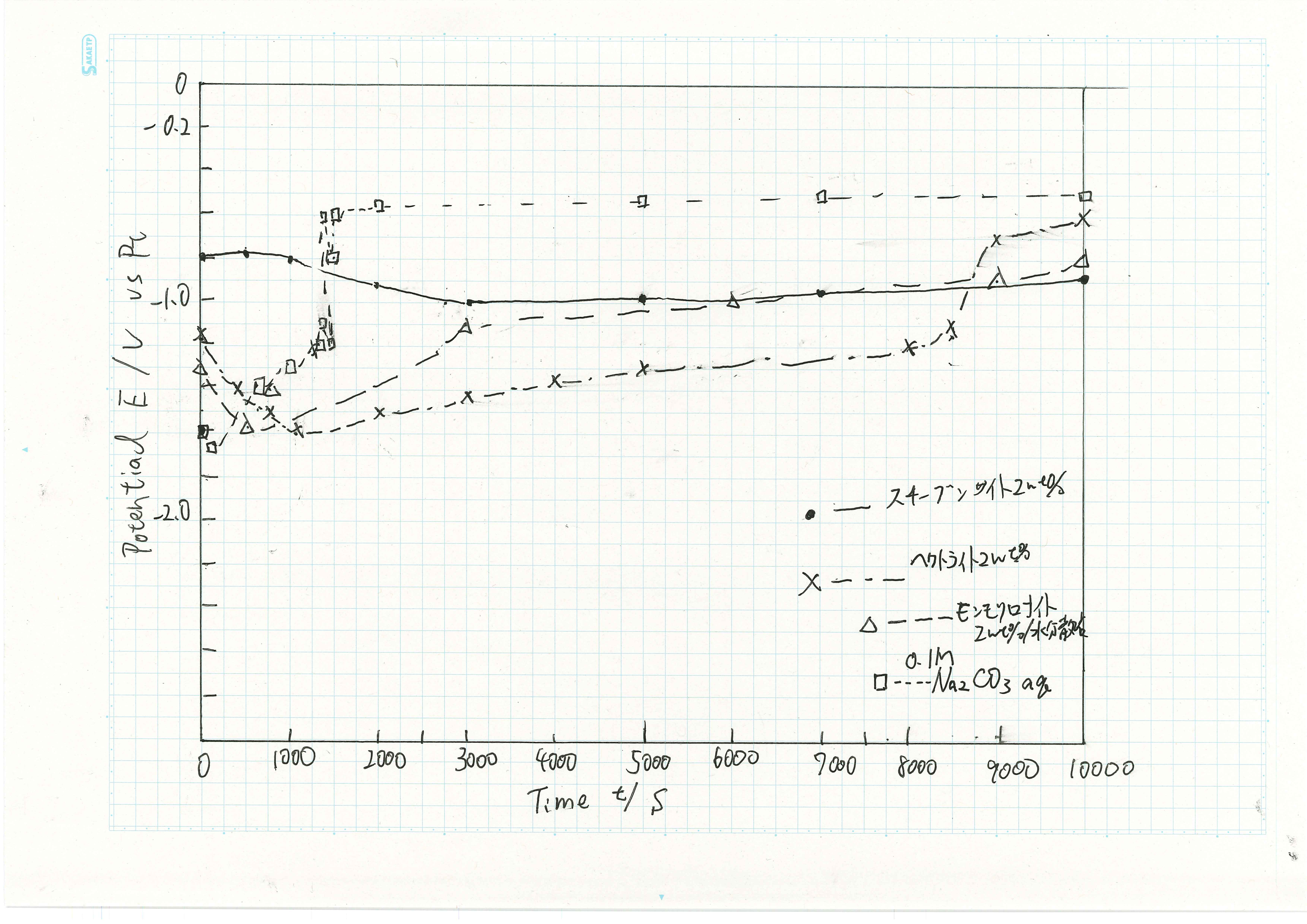
図に粘土/水分散液と0.1M Na2CO3水溶液中のアルミニウムの電位の時間変化のグラフを示す.スチーブンサイト2wt%/水分散液中では電位が最も安定していた.実験中アルミニウム板上に細かい泡がごくわずかに発生した.初めの電位は-0.8 Vであった.緩やかに電位が下がっていき4000秒で-1.0 Vとなった.その後の電位は緩やかに上昇して,実験終了時で-0.9 Vだった.
図に電位測定中のアルミニウムの様子を示す.ヘクトライト2wt%/水分散液ではアルミニウム表面の変化が最も激しかった.ヘクトライト2wt%/水分散液の初めの電位は-1.2 Vだった.200秒で1.4 Vになり,図(a)に示すようにアルミニウムの表面から泡が発生した.1800秒で-1.6 Vで,図(b)に示すようにアルミニウム表面に発生した泡が集めって大きい泡を作っていた.以降は電位が上昇して4800秒で,-1.3 Vとなり,図(c)に示すように発生した泡が集まったできた大きい泡でアルミニウム表面が覆われてた.8500秒から急激に電位が上昇して9400秒で-0.6 Vとなり,図(d)に示すようにアルミニウム表面に白色層のゲルが発生し,泡の発生は止まった.実験終了時の電位は-0.6 Vだった.
モンモリロナイト2wt%/水分散液では実験中継続的に細かい泡が発生した.モンモリロナイト2wt%/水分散液の初めの電位は-1.3 Vだった.500秒で-1.5 Vとなった.500秒経過後電位は上昇し1800秒で電位は-1.2 Vとなった.以降は電位が緩やかに上昇し実験終了時は-0.8 Vだった.
0.1 Na2CO3水溶液中でも実験中継続的に細かい泡が発生した.初めの電位は-1.6 Vで最も低い電位だった.200秒で-1.65 Vとなりその後は電位が急激に上昇して,1500秒で-0.5 Vになった.以降は電位が変化せず実験終了時の電位は-0.5 Vだった.
図に2サイクル目の粘土/水分散液と0.1M Na2CO3水溶液中のアルミニウムの電位の時間変化のグラフを示す.スチーブンサイト2wt%/水分散液中では電位は-0.95 Vで,1サイクル目の終了時点の電位と変化がなくその後の電位も一定であった.
ヘクトライト2wt%/水分散液では初め1サイクル目の終了時点の電位から200秒経過後電位が下降して400秒で-1.1 Vとなった.その後実験終了まで電位は一定で終了時の電位は-1.1 Vだった.
モンモリロナイト2wt%/水分散液では初め1サイクル目の終了時点の電位よりも高くなっており-0.35 Vだった.以降電位は下降していき500秒で-0.5V,実験終了時の電位は-0.65 Vだった.
0.1 Na2CO3水溶液中では電位は-0.5 Vで,1サイクル目の終了時点の電位と変化がなくその後の電位も一定であった.
図に実験終了時の電極の様子を示す.スチーブンサイト2wt%/水分散液に浸漬したアルミニウムは浸漬する前と変化がなかった.それ以外のアルミニウムは表面が黒変していた.モンモリロナイト2wt%/水分散液に浸漬したものが最も黒変した.ヘクトライト2wt%/水分散液に浸漬したアルミニウムは地金の部分が黒変しその上に白色層が付着していた.また泡により液面が高くなり初めに浸漬した部分より高い位置でもアルミニウムが反応していた.
アルミニウムの黒変についてはいくつかの論文で議論されている1)2)3).阿部らによると黒変したアルミニウム表面からSi,S,Cl,C,Ca,Fe,Cu,Naなどが検出されており,べーマイトが形成されるときに溶液中に含まれるイオンやアルミニウムの不純物である元素が吸着することで黒変し,Fe,Ca,Siが最も影響を与えると述べている1).さらに田中によるとpH9.5以上の水溶液中で黒色の擬似べーマイトの被膜成長を伴った孔食上の腐食が生じ,擬似べーマイトが沈着する過程で,FeやSiなどの不純物元素を取り込むため被膜は黒変すると述べられている2).腐食は(1)式の反応により一端全面に進する.(2)式の通りに溶出したアルミン酸イオンが水和することで,擬似べーマイト(γ-AlOOH)が生成され,表面に沈着することで被膜が形成される.
スチーブンサイト2wt%/水分散液では黒変しないことから(1)の反応が起きていないと考えられる.それ以外の溶液では浸漬することで一旦は初期電位より低くなってから,高い電位になるのでアルミニウム表面で腐食が起き,表面に擬似べーマイト?が出来ていることが考えられる.つまりスチーブンサイト2wt%/水分散液中にアルミニウムを浸漬してもpHによる腐食が起きないと考えられる.
水浸漬によるアルミニウム水和酸化物生成はT>60℃で擬似べーマイトが生成し,T<40℃ではバイヤライト(Al2O3・3H2O)が生成されることが報告されている4).今回常温下で実験を行っているので浸漬によるアルミニウム水和酸化物はバイヤライトの可能性が高い.しかしバイヤライトの形成時に黒変が起こるといった報告はないので表面の水和酸化物がどの状態なのかが言い切れない.
4.1.2の参考文献置き場(あとで全体の数字で合わせる)
- 1)阿部隆,相沢浩司,内山利光,磯山永三”煮沸水処理で黒変したアルミニウム表面のオージェ電子スペクトロスコピイによる一考察”,軽金属,24(1974),254-262
- 2)田中宏和,池田洋:”自動車ラジエータ用アルミニウム合金製クラッド材の冷却水側の腐食挙動”,軽金属,70(2020),268-273
- 3)田部善一:”アルミニウム合金の黒変の生成原因について”,材料と環境 : zairyo-to-kankyo,43(1994),456-457
- 4)高橋英明:”アルミニウムの酸化皮膜の構造と性質”,表面科学,9(19788),720-726
4.1.3アルミニウムの表面酸化物除去の可能性
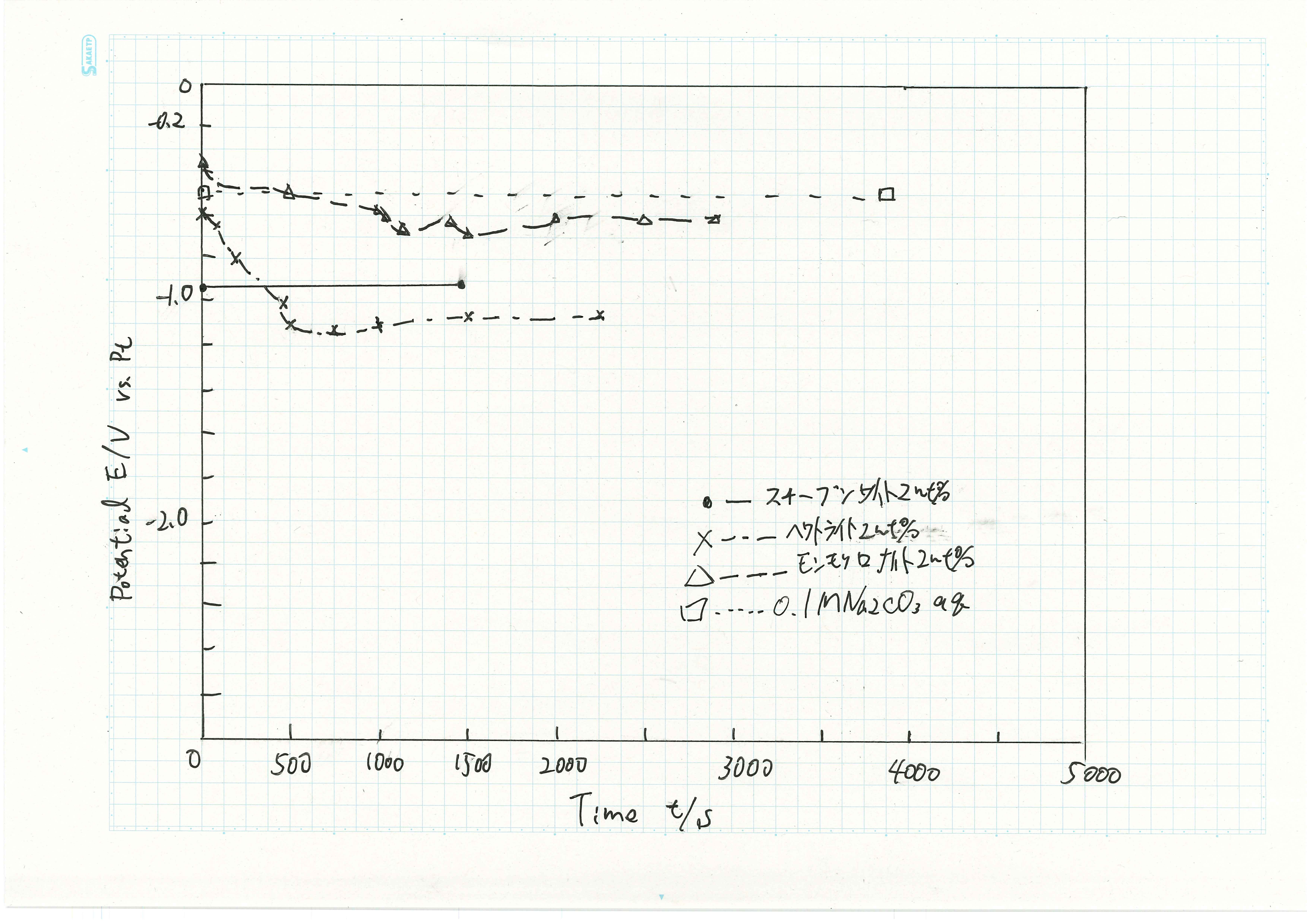
図1に未化成のアルミニウム箔の電位Eと時間tの関係を示す.ヘクトライト2wt%/水分散液中では,-1.06 Vから徐々に電位Eが減少し,8分後に-1.40 Vに達した.30分後からは泡が発生した.その後も電位Eは徐々に減少し,90分後には-1.60 Vになった.ヘクトライト2wt%/水分散液中に浸漬したアルミニウム箔を取り出すと,ヘクトライト2wt%/水分散液が付着していた。
一方,緩衝溶液中では,-0.95 Vから電位が減少した.1分後に-1.40 Vに達した.4分後から泡が発生した.90分後の電位は-1.55 Vであった.
未化成のアルミニウム箔においては,ヘクトライト2wt%/水分散液でも,緩衝溶液で同程度の皮膜除去効果が見られた。
図に19時間浸漬した後のアルミ箔の光学顕微鏡観察結果を示す.SWN2wt%分散液に19時間浸漬処理をしたアルミニウムは地金の上に網目状のもので覆われていた.孔のようなものは観察されなかった.
図 2には,化成処理後のアルミニウム箔のアノード酸化時のクロノポテンショグラムを示す.図2の1は,AA水溶液中で化成処理をしたときのクロノポテンショグラムである.浴電圧Vは電流印加1 sで3 Vを示し,電位上昇速度dV/dtが0.5 V/sで直線的に上昇し,100 sで50 Vに達した.静電容量Csは700 nFであった(図2の⓪).
図2の2は,浸漬処理過程であり,ヘクトライト2wt%/水分散液中で,50分から泡が発生した.一方,緩衝溶液中では,19時間経過しても泡は発生しなかった.ヘクトライト2wt%/分散液中に浸漬したアルミニウム箔を取り出すと,未化成箔と同様に,ヘクトライト2wt%/分散液が付着していた.
図2の3は,浸漬処理した電極を再び化成処理の結果である.粘土分散液中で浸漬処理した電極は,浴電圧Vが1 Vから電位上昇速度dV/dtが0.5 V/sで直線的に上昇し,100 sで50 Vに達した.緩衝溶液中による浸漬処理した電極は,浴電圧Vが+0.3 Vから電位上昇速度dV/dtが0.5 V/sで直線的に増加し,100 sで50 Vに達した.静電容量 Csは,840 nF(図2の①)と870 nF(図2の②)であった.
未化成のアルミニウム箔でも,化成処理したアルミニウム箔であれ,ヘクトライト2wt%/水分散液で,pH10緩衝液と同じ皮膜除去効果を有している.またどちらの溶液も静電容量が一度化成した際よりも,浸漬処理をすることで大きくなった.拡面効果によるものが考えられるが,顕微鏡観察結果から孔が生じて拡面されたというより,アルカリによる全面腐食が起きたことによって拡面処理が生じたと考えられる.しかし電位上昇速度が一度目と二度目で一緒だったことを考えると浸漬処理によって電極面積が大きくなっているとは考え難いので,化成処理した際にできる表面酸化皮膜が初めのものとは別のものができている可能性がある.pH10にした電解液中で生成した酸化皮膜は抵抗の異なる電気的な二層構造を持つことで生成する皮膜の比誘電率が大きくなるという報告がある1).再化成する際にできる皮膜は浸漬処理した際にアルミニウム箔にアルカリ溶液が残っており,再化成する際に電解液のpHを局所的にアルカリ性にしてしまうことで生成する皮膜が一度目のものとは別のものになり,生成した皮膜は比誘電率が大きいために静電容量が大きくなったと考えられる.
19時間後の化成箔を観察すると緩衝液を塗工したアルミ箔上の一部に白い結晶が析出していた.SWN2wt%分散液を塗工したアルミ箔はSWN2wt%分散液が乾燥してできた膜に覆われていた. AA溶液中で銀塩化銀電極に対する電位は,pH10緩衝液を塗工したアルミ箔は-0.35 Vであった.SWN2wt%分散液を塗工したアルミ箔は初め-1.1 Vであったが,1 mV/sで電位が上昇し-0.9 Vで電位が落ち着いた.以上のことからSWN2wt%分散液は塗工処理で表面酸化皮膜をある程度除去できることが分かった.pH10緩衝液では塗工処理のみでは表面酸化皮膜をほとんど除去できないことが分かった.
図に50 V化成箔に浸漬処理液を塗工して19時間静置して再化成を行った際のクロノポテンショグラムを示す.再化成を行うとpH10緩衝液を塗工した箔は1秒で50 Vを示し,電位上昇速度dV/dtは50 V/sで直線的に上昇した.SWN2wt%分散液を塗工した箔では15秒で43 Vを示し,電位上昇速度dV/dtは2.9 V/sで直線的に上昇した.その後,29秒で50 Vを示した.43 Vを超えてからの電位上昇速度dV/dtは0.5 V/sで直線的に上昇した.
SWN2wt%分散液はチキソトロピー性によって地面に対して垂直に塗工しても,アルミニウムの表面酸化皮膜を7 V分除去できる.
ヘクトライト2wt%/水分散液は,そのチクソトロピー性から優れた塗工適性を持ちつつ,アルミニウム表面の酸化被膜に対して,アルカリ溶液と同程度の酸化皮膜の除去能力を有する.
参考文献
4.1.4 アルミニウムのアノード酸化の可能性
図にスチーブンサイト2wt%/水分散液への8か月浸漬後の観察結果を示す.スチーブンサイト2wt%/水分散液に浸漬したアルミニウム箔の表面は変化が見られず,泡も発生しなかった.
図にヘクトライト2wt%/水分散液への8か月浸漬後の観察結果を示す.ヘクトライト2wt%/水分散液に浸漬したアルミニウム箔の表面に1 mmの黒い点ができ,その周りに5 mmの白いしまができていた。 浸漬開始して1日経過するまではアルミニウム表面から泡が発生していた.その後は表面から泡が発生することは無かったが,表面の周りに集まって大きな泡に成長した.

図にサポナイト2wt%/水分散液への8か月浸漬後の観察結果を示す.サポナイト2wt%/水分散液浸漬したアルミニウム箔の表面にヘクトライト2wt%/水分散液同様黒い点が観察されたが大きさが小さく0.5 mmだった.浸漬しているアルミニウム表面すべてが白い粉の白色層に包まれていた.泡の量はヘクトライト2wt%/水分散液より多かったが1日経過後には発生しなくなった.表面に泡が集まり大きな泡に成長した.
図にNaHCO3+NaOH緩衝液への8か月浸漬後の観察結果を示す.NaHCO3+NaOH緩衝液に浸漬したアルミニウム箔の表面は浸漬部分全面に白色層が発生して,エッジの一部が溶けていた.溶液全体も白色に濁っていた.浸漬してから1日経過するまでは表面から細かい泡が継続的に発生していたが,その後は発生しなかった.このときのアルミニウム箔表面は浸漬部分が全面こげ茶色だった.浸漬開始してから3か月後には浸漬部分が全面白色層が発生していた.

表に各種粘土/水分散液に対するアルミニウムを使用した評価結果をまとめたものを示す.表の列にサンプルの違い,縦軸に評価項目を示す.
アノード酸化限界電圧Vfeは,スチーブンサイト2wt%/水分散液に比べて,ヘクトライトとサポナイト2wt%/水分散液の方が低い.ヘクトライト2wt%/水分散液のVfeは45 V,サポナイト2wt%/水分散液のVfeは30 V,スチーブンサイト2wt%/水分散液のVfeは230 Vであった.
8か月の浸漬結果はスチーブンサイト2wt%/水分散液以外でアルミニウム表面に白色層ができた.ヘクトライトとサポナイト2wt%/水分散液に関しては1mm以下の黒い点が表面に発生した.
| ヘクトライト2wt%/水分散液 | スチーブンサイト2wt%/水分散液 | サポナイト2wt%/水分散液 | pH10緩衝液 | |
|---|---|---|---|---|
| Vfe |  dV/dt=0.25V(1分) dV/dt=0.2V(それ以降), Vfe=45V |
 dV/dt=0.3V(5分), dV/dt=0.2V(それ以降), Vfe=230V |
 dV/dt=0.13 V(1分),dV/dt=0.08 V(それ以降),Vfe=30 V |
- dV/dt=0.27V(5分), Vfe=300V |
| Al浸漬実験 | 
 |
  |
 |
 |
| 銀塩化銀に対する電位 E/V※ | -1.6 | -1.1 | 未実施 | -1.6 |
ヘクトライトまたはサポナイト2wt%/水分散液にアルミニウム箔を浸漬することでアルミニウム表面に黒い点が発生する.図に黒い点とアルミニウムの接触による局部電池のイメージ図を示す.黒い点とアルミニウムとのが接触することで,局部電池となりアルミニウムの腐食が進む.腐食により発生したアルミン酸イオンにより水和酸化物ができることにより白色層ができる.ヘクトライト2wt%/水分散液では局部腐食が起きることによって黒い点の周りに白いしまが現れ,サポナイト2wt%/水分散液では全面腐食が起きることによって浸漬部分全体に白い層がでたと推察した.

4.1.5 アルミニウム負極ゲル化剤としての可能性??
4.2粘土/水分散液の導電率
図に粘土分散液の粒度分布を示す.表に粒度分布から求めた粒子径をまとめた.スメクタイト族のキュムラント平均径は40~500 nmであった.粘土分散液の中で粒子径が最も小さいのはスチーブンサイトであった.
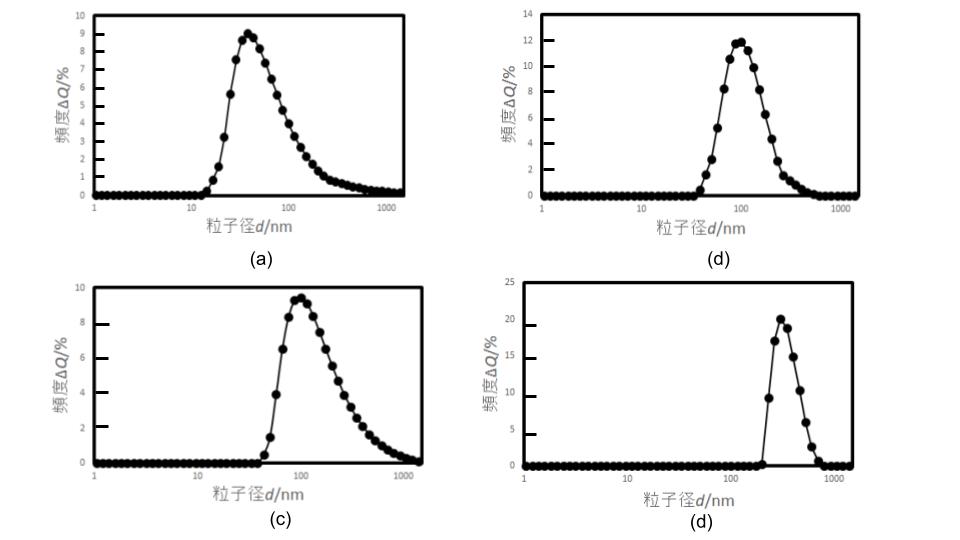
| 分散液の種類 | メディアン径 | モード径 | キュムラント平均径 | 算術平均径 |
|---|---|---|---|---|
| モンモリロナイト(KPF)2wt%/水分散液 | 310 | 284 | 526 | 350 |
| サポナイト(SA)2wt%/水分散液 | 118 | 93 | 108 | 191 |
| ヘクトライト(SWN)2wt%/水分散液 | 96 | 87 | 79 | 119 |
| スチーブンサイト(ST)2wt%/水分散液 | 49 | 36 | 46 | 98 |
表に粘土分散液中の粘土粒子の比表面積を示す.スメクタイト族の比表面積は2~15×104/m2·kg-1だった.
| 分散液名 | 比表面積Sm×104/m2·kg-1 |
|---|---|
| モンモリロナイト(KPF)2wt%/水分散液 | 1.8 |
| サポナイト(SA)2wt%/水分散液 | 5.1 |
| ヘクトライト(SWN)2wt%/水分散液 | 6.2 |
| スチーブンサイト(ST)2wt%/水分散液 | 13 |
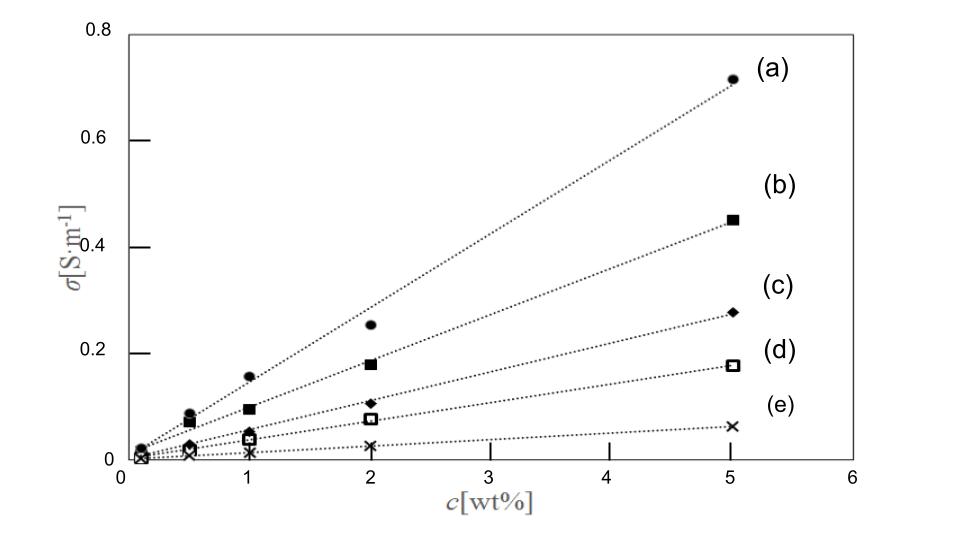
図に粘土分散液の導電率と粘土濃度の関係を示す.粘土濃度が高くなることで導電率が高くなった.また各粘土分散液に含まれる夾雑イオンを硫酸ナトリウムとしXRFの結果から求めた夾雑イオン濃度の導電率では,粘土分散液の導電率は説明がつかなかった.夾雑イオンの量は,粘土1wt%分散液に含まれる量を0.0085 gとし,2倍,5倍,1/2倍,1/5倍として粘土分散液の濃度と対応をとった.
図に粘土分散液の比表面積と濃度あたりの導電率の関係を示す.濃度あたりの導電率は,比表面積に比例した.粘土分散液の導電率を求め実験式を(4-1)式に示す.
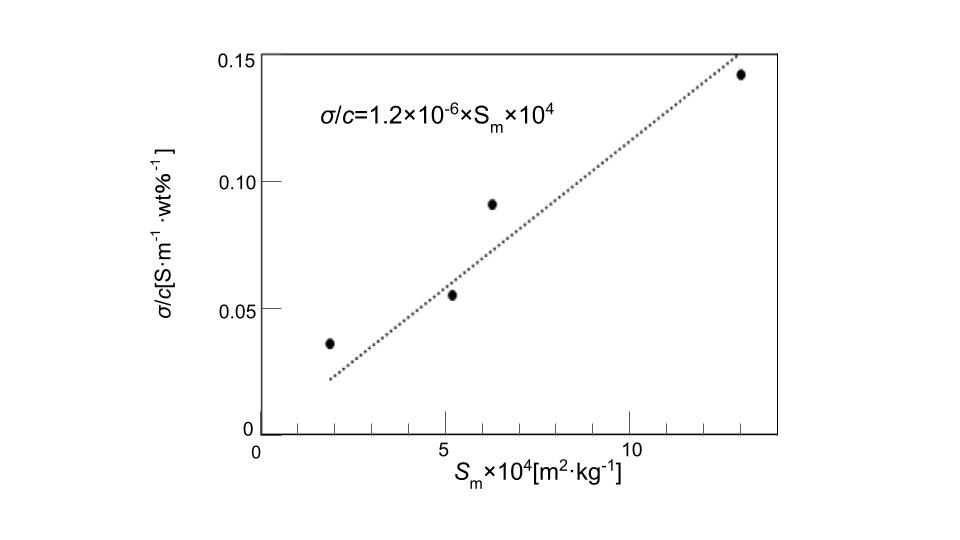
測定された導電率は,同濃度の夾雑イオン水溶液より大きかった.よって粘土分散液では,粘土粒子の表面に存在するイオンが電荷を運び,それは夾雑イオン以外であると考えられる.粘土分散液のpHが10付近であることから,電荷を運ぶイオンとして,水酸化物イオンが示唆される.
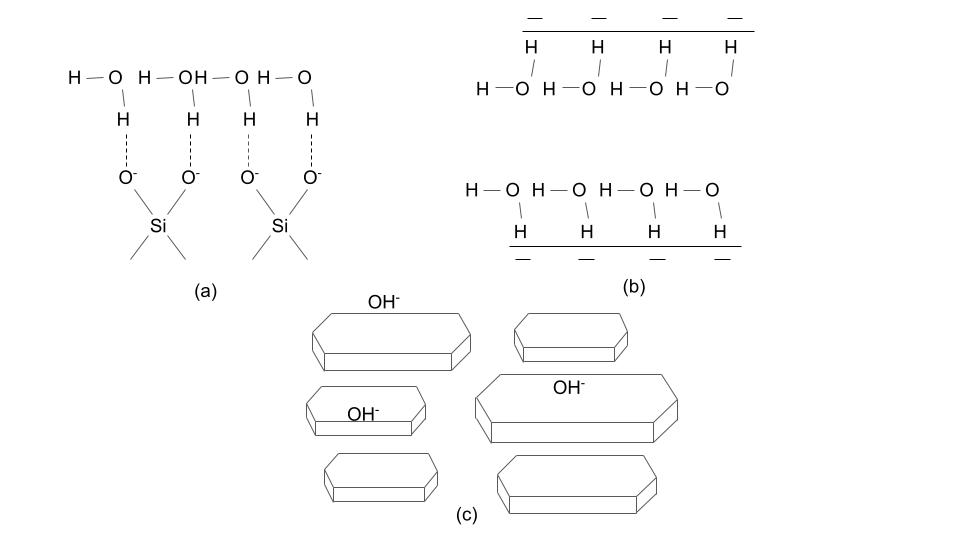
図に粘土分散液中の粘土粒子表面に存在する水酸化物イオン伝導のイメージ図を示す.図の(a)のようにスメクタイ族の四面体のSi-O結合端面のO-に水が吸着しフリーな水酸化物イオンが表面に存在することになる.また図の(b)のように粘土分散液中の粘土粒子は電気二重層のBDMモデルのようになっており表面に水が吸着しその外側に水に水和したカチオンが存在していると考えられる.
つまり粘土分散液中では,粘土粒子がナノシートとして配向し,図(c)のようなナノシート表面に存在する水酸化物イオンによって二次元イオン伝導が実現していると思われる.
4.2正極バインダーとしての可能性
Auの前処理から廃液処理まで 金線切り出し実験方法 打ち込み電極作成 0331式セルの作成方法 MnO2放電時の粘土分散液の影響4.3EDLC?
5.結言
本論文では粘土分散液の構造と粘土濃度の関係に及ぼす夾雑イオンの影響について論じてきた.粘土分散液を分極した際に生成する層は粘土分散液の構造には影響されないが,夾雑イオン量による影響があった.粘土分散液と金属の反応は構造によって反応が違う.粘土分散液の導電率については構造や夾雑イオンによらず粘土粒子の比表面積に比例する.
6.参考文献
文献
-
中戸晃之. -
中西英二. 機能性ペプチドゲル
. 高分子48巻6月 号(1999年)411. -
田 中 穰*・ 長 田 義 仁*. 高分子ゲル
. 「熱硬化性樹脂」Vo1.15No.4(1994). -
鴇田 昌之/引地 邦男. ゲル化とゲル構造
. 高分子37巻10月 号(1988年). -
住友精化株式会社,国立研究開発法人産業技術総合研究所. 粘土膜、及びその製造方法
. 特開2018-177631. 2018-11-15.
学会発表
-
田邉悠, 樋口和馬, 伊藤智博, 立花和宏, 仁科辰夫. 粘土分散液を使った分極による電極近傍の粘性制御
. 表面技術協会 第144回講演大会, オンライン開催. 2021. -
立花 和宏, 伊藤 智博, 田邉 悠, 仁科 辰夫, 後藤 佑太, 篠木 進. セル通電に伴う粘土/水分散液による電極冷却
. 第61回電池討論会. 2020. -
田邉 悠、本間史将、伊藤智博、立花和宏、仁科辰夫、後藤佑太、篠木進. 粘土分散液を使った金属表面酸化物除去と化学研磨の可能性
. 第143回講演大会, 山梨大学(オンライン). 2021. -
田邉 悠、西 成実、石山 祐貴、伊藤 智博、立花 和宏、仁科 辰夫. 粘土材料の液晶化による電気的配向現象におけるエネルギーデバイスとしての可能性
. 2019年電気化学秋季大会, 山梨大学甲府キャンパス. 2019.
研究結果
学外からFTPクライアントソフトを利用して学内サーバーに繋ぐ方法
AI仕様書2020年度前期電気化学特論の授業内での私の発表を仁科先生がメールでまとめてくれたものを立花先生がaspにまとめてくれたやつ
ここにはこのページのURLを示す。 URL https://edu.yz.yamagata-u.ac.jp/Public/54299/2020/tka23723/haruka_tanabe.asp

お友達リンク
連絡先:田邉 悠 mail:tka23723@st.yamagata-u.ac.jp
山形大学院 工学部 物質化学工学専攻 C1ラボラトリー
〒992-8510 山形県 米沢市 城南4丁目3-16
3号館(物質化学工学科) 3-3301
Tel: 0238-26-3573
URL: http://c1.yz.yamagata-u.ac.jp/