粘土/水分散液を担持した電極での電池正極材料の充放電. 第61回電池討論会,オンライン開催,2020/11/18
昨今、電気自動車の動向が活発になっている。表に主な電気自動車の充電時間を示す。 i-MiEV MとLEAF急速充電するとその充電時間は1/25なった。急速充電の電流は公式に書いてなかったが、単純に電流が大きくするとその電流値は375Aの大電流となる。
| 車種 | 総電力 kWh | 普通充電 h | 急速充電 m |
| i-MiEV M(三菱) | 10.5 | 4.5(200V,15A) | 15 |
| LEAF(日産) | 62 | 24.5 (200V,15A) | 60 |
電池の抵抗による発熱は下記の式(1)で表せる。この発熱は本来 充電に使うためのエネルギーが熱に変わってしまうので、無駄になる。そのため、地球温暖化防止の為にも内部抵抗を小さくする必要がある。
電池は正極と負極と電解液で構成される。 リチウムイオン電池の正極はマンガン酸リチウム等の活物質,アセチレンブラック等の炭素導電助剤,ポリフッ化ビニリデン等の バインダーをスラリー状に混ぜ、アルミニウムなどの集電体金属に塗布して作られる。 負極ではカーボンと,ポリフッ化ビニリデン等のバインダーをスラリー状にして金属集電体に塗布して作ります 1) 1 ) 図に正極にマンガン酸リチウムを使用した時のリチウムイオン電池の反応の様子を示します。
正極では導電助剤が、集電体とマンガン酸リチウムまでの電子の導電パスを形成します。そして、マンガン酸リチウムは導電助剤と電解液が接触する三相界面
2
)
でリチウムイオンの脱挿入反応が行われます。
リチウムイオンが抜けると充電し、リチウムイオンが入ると放電します。
負極ではリチウムイオンが、カーボン粒子内に入り充電し、リチウムイオンが抜けると放電します。
リチウムイオン電池の正極にはアルミニウムが使用されている理由としては
以下が挙げられる。
1)正極集電体として使用される電位領域ではリチウムイオンがアルミニウム箔にドープしない。
2)導電性が良好である。
3)強固な自然酸化被膜に覆われている。(5~10nm)
4)電池内でさらに耐食性の高い皮膜が形成される。
5)アルミニウム箔表面に導電性がある。
6)入手しやすく,低コストである。
7)加工性に優れる。
等がある。
負極集電体には銅が使用されている理由を下紀に上げる
1)リチウムイオンが銅箔にドープしない。
2)導電性が良好である。
3)入手しやすく,低コストである。
4)加工性に優れる。
3
)
1991年にソニーからリチウムイオン電池が発売された。その時に発売された時にはコバルト酸リチウムが使われた。コバルト酸リチウムは合成が簡単で、作動電圧が高く、サイクル特性に優れている等の理由から使われてきた 4 ) 。
マンガン酸リチウムは毒性が低く、コバルト酸リチウムと比べて安い。コバルトが1kg当たり28ドルに対し、マンガンは1.9ドルとコストが1/15倍と安くなっている。 5 ) しかし、マンガン酸リチウムはサイクル性が良くないという問題がある。その原因の一つとしてして、充放電時にマンガン酸リチウム中のMn3+の溶出が挙げられる 6 ) , 7 ) 。
金線に2種類のマンガン酸リチウムを打ち込み、LiPF6/EC+DEC(1:1)溶液中で掃引速 度200 mV/secでCV測定を行うと高速マンガン酸リチウムでは酸化還元のピークが観測できたが、比較用マンガン酸リチウムではピークが見えなかった。高速マンガン酸酸リチウムと比較用マンガン酸リチウムのXRD測定による結晶構造による違いは見られなかった。しかし、XPSで活物質の表面を分析すると、高速マンガン酸リチウムの表面には硝酸由来の付着物が検出できた。 8 )
マンガン酸リチウムをSEMで画像を取ると、比較用マンガン酸リチウムの二次粒子は粒子径が20 μmで、歪な球形だった。一次粒子は粒子径が数百~数千nmをしていた。高速マンガン酸リチウムの二次粒子は粒子径が10 μm程度の大きさで球状になっていた。一次粒子の粒子径は数十nmだった。
リチウムイオンの活物質としてリン酸鉄リチウムがある。このリン酸鉄リチウムは3.3Vで平坦な放電プロファイルを持っている。リン酸鉄リチウムは下記の特徴を備えている。 ①レアメタルフリーであること ②比重量エネルギー密度がマンガン酸リチウム(LMO)より凌いでる。LMOが110 mAh/g LFPが170 mAh/g ③酸素脱離が少なく、熱安定性に優れている。 ④満充電相が化学的に安定 ⑤Fe3+,Fe2+と共にマンガンのように不均化反応が起きない。 などがある。N.Ranetの特許ではLFPにポリプロピレンやより安価な糖類を添加し、Ar中700 ℃で焼成しており、添加物の炭化による正極粒子表面に炭素をコートが導電性付与と炭素の還元作用による鉄3価不純物の発生防止、双方の効果をもたらす。 9 )
上原によると、リン酸鉄リチウム自体の導電率は10-8S/cmだが2nmのカーボンをコーティングする事で、その導電率は10-2S/cmまで向上したと述べている。 10 )
Daniel Gordon らによると水がリン酸鉄リチウムの表面にコーティングしてる カーボンを通り越して、リン酸鉄リチウムを攻撃すると述べられている。電解液の濃度が低いほど溶出反応が大きくなり、サイクリックボルタモグラムも電解液中のリチウムイオ ンの濃度が低くなると、ピークが卑な方向にシフトすると述べられている。 11 )
活物質の性能を表に示す。
| 名称 | コバルト酸リチウム(LiCoO2) | マンガン酸リチウムリチウム(LiMn2O4) | リン酸鉄リチウム(LiFePO4 |
| 作動電位(V vs Li) | 3.6~3.7[1] | 3.8~3.9 | 3.2~3.4[1] |
| 重量エネルギー密度(mAh/g) | 120~130 | 110~120 | 150~160[1] |
| 導電率 (S/cm) | 10-2, | 10-6[2] |
カーボンコート無し。10-8
カーボンコート有り,1.25×10-1 |
| 比誘電率 | 3.6 | 2.3,6.3~14 | 3.0 |
カーボンコートされたリン酸鉄リチウムの表面にGaやSiをコーティングすると、抵抗が小さくなると述べている。 14 ) , 15 ) つまりリン酸鉄リチウムは粒子の表面状態によって抵抗が変わると述べている。
セルの電極電位は式(2)で表される。
E=Ee-ηac-ηch-ηmt-IR
この時のRは接触抵抗と溶液抵抗などの
16
)
仁科らは充放電速度の目標は100Cレートであり、その条件をオームの法則とファラデーの法則を組み合わせて、下の式で表した。
m≦η/(σQC) (3)
ここで、mは集電体の単位面積当たりに塗布する活物質量[g/cm2], σは集電体の単位面積当たりの電池系全体の内部抵抗[Ωcm2]、Qは活物質の理論容量[Ah/g]、Cは要求されるCレート[h-1]、ηは熱力学的な平衡電位から許容する過電圧[V]である。 Q,Cは自動的に決まるので目標のCレートを達成するには、内部抵抗を小さくする必要がある。 17 ) 18 )
集電体と活物質が接触すると接触抵抗が発生します。 接触抵抗は被膜抵抗と集中抵抗の和です。 集中抵抗はマンガン酸リチウムとアルミニウムの接触点で酸化被膜の破壊が起こり、 電流密度が他の部分より大きくなる事で発生する抵抗です。 被膜抵抗は 金属導体の表面に酸化膜などの皮膜が形成された場合、電流は皮膜を介して流れる。 皮膜の抵抗率は金属導体よりも一般的に大きく、この部分の抵抗を言います。 19 )
小野寺らは、アルミニウムの酸化被膜と電極合材との被膜抵抗は下の式で表されると述べています。活物質の誘電率が大きくなると、接触抵抗が大きくなります。
Rc = ( ρ0∑i Ci Xe,i+ρ0 ) ( d + d0 ) (2)
20
)
加藤らは、小野寺らの理論を掘り進め、表面処理を施したアルミニウム集電体を用いて、電極合材との接触抵抗の発現要因を論じて おり、炭素材料や相互拡散層で遮蔽することで、接触抵抗を低減できると述べています 21 )
リチウムイオン電池には定電流定電圧制御方式で充電されている。これは定電流で充電を行い、目標の電圧に達したら、定電圧を制御する。もし、リチウムイオン電池の電圧がさらにさらに上昇し、過充電を行うと電解液成分の分解や活物質の溶解、リチウムデンドライトの発生などの副反応が起こる。 22 )
リチウムイオン電池を急速充電する方法は、最初から定電圧で充電すれば、直ぐに充電が可能である。しかし、急激に電圧を変化させると大電流が発生するため、抵抗による熱が発生しやすく、電池が熱を発生させる。
n型半導体電極と電解液が接触すると、伝導帯に存在する電子が低いエネルギー状態にある酸化体に移って還元体を生成する。フェルミ準位の低下を伴いながら、反応は進行しEF=ΦROで平衡になる。ドナー濃度が酸化還元系濃度に比べて著しく小さいため、内部でのドナー電子が反応に使われる。電子と対で存在した正孔が界面から内部に向かって分布する。一方、溶液側には負電荷が蓄積する。この関係は、金属電極-電解液界面の二重層構造を裏返した形である。この半導体内に生じた電荷分布層を空間電荷層と呼ばれる。電子または正孔の分布がBoltzman則に従い、Poisson式が適用できるとすると、真性半導体の場合にはその微分容量として、次の式が導かれる。
金属では温度が上昇すると共に導電率が小さくなる。
半導体は絶対零度では導電性を示さない。しかし、 バンドギャップが小さい真性半導体は温度を上げると、充満帯にある電子が励起されて、伝導体に入り、自由電子になる。また、充満帯では正孔ができる。どちらもキャリアーとなり 導電性が出てくる。 23 ) 。
金属と半導体を接触すると、整流性が現れる場合と、整流性のないオーム性電電流が流れる場合がある。前者をショットキー接触,後者をオーミック接触と呼びます 25 ) 。
ショットキー接触をするとき、空乏層が形成される。空乏層の説明をn型半導体と電解液の接触で説明する。
半導体に高電界を印加すると、キャリア濃度が急激に増加する現象がある。この機構には、なだれ効果とツェナ効果がある。
なだれ効果は高電界中でキャリアが加速されて運動エネルギーが増大して、そのエネルギーを格子に与えて新しく電子-正孔対が形成され、この過程を繰り返してキャリアが増大し導電率が大きくなる。
ツェナ効果の前に量子力学的トンネル効果について説明する。エネルギー障壁の高さが十分に高くて、電子のエネルギーよりも大きいとする。 電を粒子とすると、電子はこの障壁を超える事ができず、境界で反射されてしまう。しかし、電子を波動と考えると この障壁中にしみこんで行くことが可能になる。この効果をトンネル効果と呼ぶ。
このトンネル効果で、伝導帯中へにじみ出て電気伝導現象が現れる現象をツェナ効果と呼ぶ。
一般に降伏電圧が大きい場合はなだれ機構、小さい場合はツェナ機構による。
なだれ効果は電子の散乱確率が上昇と共に大きくなり、電子のドラフト速度は小さくなる。その結果同じ運動エネルギーを得るには電界を大きくしなければならない。従ってなだれ効果による降伏電圧の温度係数は図のように正になる。
ツェナ効果は禁制幅が小さいほど大きくなるが、一般に温度が高くなると禁制帯幅は小さくなる。そのため図に示すようにツェナ効果による降伏電圧の温度係数は負になる。 26 )
福永ら、Cr/Au電極をスパッタした状態の電圧-電流特性を調べた。するとオーミック特性を示した。温度が上昇とともに電圧-電流直線の傾きが小さくなった。 27 )
西らが作成したセルの予想される等価回路図を示します。 セルにおける電気的特性を支配する主な要素は、4つと考えられます。 ひとつめは 集電体と粒子の接触抵抗Rcです。こちらは固体同士の点接触です。 点接触では圧力による接触状態の変化が、接触抵抗を変化すると予想されます。 ふたつめは 粒子と粒子の接触抵抗Rpです。固体同士の点接触です。 みっつめは 結晶と結晶の界面抵抗Riです。こちらはいわゆる結晶子どうしの面欠陥であり、面接触の接触抵抗と考えられる。 よっつめは マンガン酸リチウム結晶のバルクの電気抵抗Rbです。これはマンガン酸リチウムの電子伝導機構そのものに起因します。
水の電気分解は1.23 Vで発生する。
下に亜鉛の電位-pH図を示す。直線①以下では水素発生の反応が起こり、
2H+→H2
一方、破線②は酸素発生反応が起こる。
2H2O→O2+4H+
その電位差は1.23Vである。
28
)
有機電解液はリチウム塩を入れれば導電率が大きくなるが、入れすぎると電解液の粘度が上昇するという問題がある。また、有機電解液は導電率が小さい。代表的な有機電解液はLiPF6/EC:DEC=1:1の電解液では11.3mS/cmとかなり小さい 29 ) 30 )
粘土を使ったリチウムイオン電池の研究は盛んにおこなわれている。例えば、モンモリロナイトナノシートを使用したときの全固体電池の開発 31 ) やゲル電解質等 32 ) の研究があった。 M.Dekaらの研究によるとPVdFとモンモリロナイトを使用したゲル電解質はリチウムイオンの伝導度を上昇し、リチウム電極との界面抵抗を減少させると述べている 33 ) 。
電極反応が生じる電位まで電位をステップさせて、電流の時間的な変化を見る方法をクロノアンペロメトリーという。 34 )
3電極方式によるボルタンメトリー測定おいて注目してるの作用電極の電位がどこに設定されてるかは、重要な事柄の一つである。電位の基準になる電極が参照電極(基準電極、照合電極ともいわれる)
理想的な参照電極として、次の性質が必要である。
1 参照電極表面での反応が可逆で電解液中のある化学種とNernstの平衡電位式に従って応答すること。
2 その電位は時間に対して安定であること
3 その電位は微小電流が流れたとしても、すぐ最初の電位に戻ること
4 Ag/AgClのような場合には、固体層が溶解しないこと
5 温度が変化しても、一定の温度になれば一定の電位を出すこと
現在よく使われてる参照電極は、次の3種類に分類される。
1 金属層や溶解してる化合物がそのイオンと平衡になってる系
2 金属層が、わずかに溶けているその金属と平衡になってる系
3 その他の系
がある。
銀・塩化銀電極は取り扱いが容易で、電位の再現性もよく、しばしば使われる参照電極の一つである。
電位発生反応は次式である。
AgCl+e-→Ag+Cl-
電解液中のKClの濃度によって電位は変化する。25℃において
飽和KClで0.199 V (vs.NHE)
35
)
(電気化学測定法 p96)
本研究ではリチウム電地の内部抵抗を下げる方法を検討した。
使用した試薬の一覧を表に示す。
| 試料名 | 略称 | ID | Cabinet ID | 提供元 | 備考 |
|---|---|---|---|---|---|
| 高速マンガン酸リチウム | HSLMO | 14342 | 359 | 共同研究先 | LiMn2O4 |
| 比較用マンガン酸リチウム | RefLMO | 14273 | 321,359 | 共同研究先 | LiMn2O4 |
| L191111 | HSLMO11 | 14426 | 359 | 共同研究先 | LiMn2O4,2019/11/11作成 |
| L191114 | HSLMO14 | 14427 | 359 | 共同研究先 | LiMn2O4,2019/11/14作成 |
| L191118 | HSLMO18 | 14428 | 359 | 共同研究先 | LiMn2O4,2019/11/18作成 |
| L191121 | HSLMO21 | 14429 | 359 | 共同研究先 | LiMn2O4,2019/11/21作成 |
| L191122 | HSLMO22 | 14430 | 359 | 共同研究先 | LiMn2O4,2019/11/22作成 |
| L191125 | HSLMO25 | 14431 | 359 | 共同研究先 | LiMn2O4,2019/11/25作成 |
| L191206 | HSLMO06 | 14434 | 359 | 共同研究先 | LiMn2O,2019/12/06作成 |
| L191209 | HSLMO09 | 14435 | 359 | 共同研究先 | LiMn2O4,2019/12/09作成 |
| 高速マンガン酸リチウム 粗粉 | HSLMO-L | 14447 | 359 | 共同研究先 | LiMn2O4 |
| 高速マンガン酸リチウム 微粉 | HSLMO-S | 14448 | 359 | 共同研究先 | LiMn2O4 |
| 高速マンガン酸リチウム 900℃処理 | HSLMO-900 | 14449 | 359 | 共同研究先 | LiMn2O4 |
| リン酸鉄リチウム | LFP | 10016 | 329 | LiFePO4 | |
| 金線 | 13635 | 322 | |||
| アルミニウム1085箔 | Al箔 | 13932 | 213 | ||
| アルミの相互拡散箔 | b箔 | 13998 | 213 | ||
| アルミのカーボンコート | CC | 13535 | 213 | ||
| アルミニウムの炭素担持箔 | TT | 14334 | 214 | ||
| 金箔 | Au箔 | 14623 | 214 | ||
| 銀箔 | Ag箔 | 14624 | 214 | ||
| ニッケル箔 | Ni箔 | 14625 | 214 | ||
| 銅箔 | Cu箔 | 14625 | 214 | ||
| カーボンナノチューブ不織布 450 | CNT450 | 14409 | 214 | ||
| カーボンナノチューブシート | CNTs | 14409 | 214 | ||
| プラチナ線 | Pt線 | 110 | 銀線 | 110 | |
| 硝酸リチウム | LN | 14437 | 327 | 和光特級 | |
| 水酸化リチウム‐水和物 | LOH | 7078 | 80 | 和光特級 | |
| 硫酸ナトリウム | NS | 7086 | 80 | 和光特級 | |
| 塩酸 | 13386 | 80 | 和光特級 | ||
| 硝酸 | 13996 | 80 | 和光特級 | ||
| 塩化カリウム | 14000 | 80 | 和光特級 | ||
| スチーブンサイト2wt%水分散液 | ST | 14478 | |||
| モンモリロナイト2wt%水分散液 | KPF | 14483 | |||
| モンモリロナイトリチウム4wt%水分散液 | KPM | 14457 | |||
| スチーブンサイトリチウム水分散液 | STL | 14480 | 80 |
使用した器具を示す
| 器具名 | ID | Cabinet ID | 提供元 | 備考 |
|---|---|---|---|---|
| 10mlビーカー | ||||
| マイクロチューブ | ||||
| 薬包紙 | ||||
| ろ紙 | ||||
| 30mlディスポカップ | ||||
| 300mlビーカー | 4792 | 325 | ||
| 画びょう付き洗濯ばさみ | ||||
| スパチュラ |
使用する装置を表に示す
| 装置名 | ID | Cabinet ID | 個数 |
|---|---|---|---|
| ポテンショガルバノスタット HA-151 | |||
| 関数機能付きポテンショガルバノスタット HA-151B | |||
| インキュベーター | |||
| 赤外線サーモグラフィー | |||
| X-Yレコーダー WX2200 | |||
| X-Yレコーダー | |||
| ファンクションジェネレーター |
銀・塩化銀電極の作成方法は電気化測定法上を参考にして作った。
ドラフト中で 0.1M 塩酸と3M 硝酸を調整した。 銀電極の表面を紙やすりで磨き、硝酸で60秒洗浄した後、純水で60秒洗浄した。 塩酸が入ったディスポカップ中に、白金と銀を入れた。白金電極をカソード、銀電極アノードに接続した。 ガルバノスタットで0.8mA/cm2の定電流で15分間通電した。 同様の手順で2本目の銀塩化銀電極を作成した。2本の銀塩化銀電極を飽和KCl溶液中に入れて、電圧を測定した。 。
100mlビーカーに純粋を30ml注ぎ、飽和するまで塩化カリウムを入れた。マイクロピペットに1mm角に切ったろ紙を詰め込み、飽和塩化カリウム溶液を入れた。 マイクロピペットに銀塩化銀を入れて、シールテープで開口部をふさいだ。
φ=0.3の金線を3cmにカットして、前処理を行った
Al箔とAlb箔をカッターを使用して3×30mm2に切り出した。
金線の前処理は小野寺の方法に従った
36
)
。
金線の切り出し, https://edu.yz.yamagata-u.ac.jp/auth/54299/2020_R02/tka23723/2021_0309/2021_0309_auwire.asp
金線の前処理, https://edu.yz.yamagata-u.ac.jp/Public/54299/2020/tka23723/how_to_preprocessing/20210322_preprocessing.asp
薬包紙に勝つ物質を10mgと前処理した金線を入れて包み込んだ。ブロック塀の上にカッター板を置いた。包んだ薬包紙をカッター版の上に置き、ハンマーで薬包紙を叩いた。電極をピンセットで掴み、圧着工具を用いて圧着端子R2-4を電極の端に圧着した。
打ち込んだ電極を電極ケースに保存した。
2つの10mlビーカーを用意し、6Mの硝酸リチウム溶液を10ml入れた。三つの穴が開いたテフロンキャップにリード付きワニ口クリップを差し込んだ。真ん中に対極をセットし、見かけの電極面積が1cm2になるようにした。対極から1cm離して試料極をセットし、見かけの電極面積が0.2cm2試料極の近くに塩橋であるろ紙をセットした。二つ目のビーカーには作成した、銀塩化銀電極を入れた。これをダブルブリッジセルと名付ける。
1つの10mlビーカーに銀塩化銀電極、作用極、対極をセットした。
大前が設計したセル蓋を3Dプリンターで作成した。30mlのディスポカップに、6Mの硝酸リチウム水溶液を30ml注いだ。試料極と対極を電極間距離1cmにセットした。銀塩化銀電極を試料極と対極の間に入れた。これを920式ディスポカップセルと名付けた。
作成したセルを表に示す。
| 略称 | 電池式 | 使用したセル | ||
|---|---|---|---|---|
| Au-HSLMO-6LN-1 | Au|HSLMO|6M.LiNO3<.aq|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-HSLMO-6LN-2 | Au|HSLMO|6M.LiNO3.aq|SUS430 vsAg|AgCl sat.KCl | 920式ディスポカップセル | ||
| Au-RefLMO-6LN-1 | Au|RefLMO|6M.LiNO3.aq|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-RefLMO-6LN-2 | Au|RefLMO|6M.LiNO3.aq|SUS430 vsAg|AgCl sat.KCl | 920式ディスポカップセル | ||
| Au-11LMO-6LN-1 | Au|HSLMO11|6M.LiNO3.aq|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-14LMO-6LN-1 | Au|HSLMO14|6M.LiNO3.aq|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-18LMO-6LN-1 | Au|HSLMO18|6M.LiNO3.aq|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-21LMO-6LN-1 | Au|HSLMO21|6M.LiNO3.aq|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-22LMO-6LN-1 | Au|HSLMO22|6M.LiNO3.aq|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-25LMO-6LN-1 | Au|HSLMO25|6M.LiNO3.aq|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-06LMO-6LN-1 | Au|HSLMO06|6M.LiNO3.aq|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-09LMO-6LN-1 | Au|HSLMO09|6M.LiNO3.aq|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-HSLLMO-6LN-1 | Au|HSLMO-L|6M.LiNO3.aq|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-HSSLMO-6LN-1 | Au|HSLMO-S|6M.LiNO3.aq|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-LMO-KPM-1 | Au|LMO|KPM|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-LFP-STL-1 | Au|LFP|STL|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-LFP-0.06LiOH-1 | Au|LFP|0.06wt%.LiOH|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-LFP-KPF-1 | Au|LFP|KPF|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-LFP-0.04NS-1 | Au|LFP|0.04wt%.Na2<SO4<|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル | ||
| Au-LFP-KPM-1 | Au|LFP|KPM|SUS430 vsAg|AgCl sat.KCl | ダブルブリッジセル |
セロハンテープに皮ポンチで穴Φ10の開けた。アルミニウム,チタン,銅の集電体を1.5×1.5 cm2の大きさ,金,銀,CNTの不織布は1.0×1.0cm2で切り出した。穴を開けたテープを貼り付けた集電体を2枚用意した。 テープを貼り付けてない面に活物質0.2g(スパチュラで2杯)を載せ、平らにした。もう一枚の集電体で活物質を挟み、背面に貼ってあるテープでしっかりと重ね合わせ、余分な部分をはさみで切った。 最後に、集電体が露出してる部分にゼムクリップを当て、セロハンテープでゼムグリップを固定した。
作成したセルを一覧表に示す。
| セルの略称 | ID | Cabinet ID | 電池式 | 備考 |
|---|---|---|---|---|
| Al-RefLMO | Al|比較用マンガン酸リチウム|Al | |||
| b-RefLMO | Al|b|比較用マンガン酸リチウム|b|Al | |||
| Al-HSLMO | Al|高速マンガン酸リチウム|Al | |||
| b-HSLMO | Al|b|高速マンガン酸リチウム|b|Al | |||
| Cu-HSLMO | Cu|高速マンガン酸リチウム|Cu | |||
| Ti-HSLMO | Ti|高速マンガン酸リチウム|Ti | |||
| TT-HSLMO | TT|高速マンガン酸リチウム|TT | |||
| CC-HSLMO | CC|高速マンガン酸リチウム|CC | |||
| Au-HSLMO | Au|高速マンガン酸リチウム|Au | |||
| Ag-HSLMO | Ag|高速マンガン酸リチウム|Ag | |||
| Ni-HSLMO | Ni|高速マンガン酸リチウム|Ni | |||
| CNTs-HSLMO | CNTs|高速マンガン酸リチウム|CNTs | |||
| CNTs-HSLMO | CNTs|高速マンガン酸リチウム|CNTs |
作成したセ作成した3極式セルのボルタモグラムを測定した。測定には北斗電工製の関数機能付きポテンショ・ガルバノスタットとX-Yレコーダーを組み合わせて使用した。 ポテンショスタットHA-151の電源を入れた。セルの試料極にTO-CELL-OUTコードのWE1とWE2をつないだ。対極にCEをつないだ。参照極にREをつないだ。セルのRestPotentialから各々の条件で電位を掃引し測定した。
ガルバノスタットに作成した三極セルをガルバノスタットに接続した。RestPotentialでOCPを測定した後、定電流で通電した。10μAで定電流を流し、1.2Vvs AgCl sat.KClに達する時間を記録し、1.2Vに達した時間を充電率100%と仮定した。一度放電した後、SOC=50%まで充電し電流を止めた。 10,20.30,40,50μAの電流を流し、その時のIRジャンプをモニターで計測した。 同じ手順でSOC=70%,90%のIRジャンプを確認した。
ガルバノスタットをX-Yレコーダーもしくは、データーロガーを接続した。作成した三極セルをガルバノスタットに接続した。RestPotentialでOCPを測定した後、定電流40μAの定電流を通電した。活物質にマンガン酸リチウムを使用した時は1.3 Vを充電終了電位とし、リン酸鉄リチウムを使用したときは0.8 Vを充電終了電位とした。
測定したクロノポテンショグラムから、内部抵抗を求めた。
作製したセルを画鋲が付いた洗濯ばさみで挟み圧力を加え、ゼムクリップを定電圧源に接続し、掃引速度100 mV/s、掃引範囲-5 V ∼+5 Vで、電圧-電流密度曲線を測定した。
接触抵抗と温度の関係性を見るために、インキュベーターを使用した。 1台を-2℃に、もう一台を40℃に設定した。
40℃に設定したインキュベーターの中にAl-比較用セル,b箔-比較用セルを入れた。-2℃に設定したインキュベーターの中にAl-高速,b-高速のセルを入れた。インキュベーターの外で図の回路を組んだ。インキュベーターの穴から、to-cell-outコードを入れて、セルのゼムクリップにワニ口クリップを噛ませる。
掃引速度100 mV/s、掃引範囲-5 V ∼+5 Vで、電圧-電流密度曲線を測定する。2~3サイクルを取ったら、ペンを上げて掃引速度を500mV/secに変えて、電圧-電流密度曲線を2~3サイクル取った。測定し終わったら、インキューべーターから取り出し,-2℃に設定したインキュベーターに入れ10分間静置した後、同様の測定を行った。 同様の操作をb箔-比較用セルで行った。
高速マンガン酸リチウムのセルは-2℃を測定し終えた後、40℃のインキュベーターの中に入れ測定した。
測定した電圧-電流密度曲線の傾きから、抵抗の逆数であるコンダクタンスを求めました。そして、接触コンダクタンス G と電流密度 j の関係をプッロトし、G=aj+b の式で近似して、傾き a を算出した。
作成したセロハンテープクリップセルに関数機能付きポテンショスタットを接続し、5Vの定電圧を印加した。ストップウォッチで時間を測定しながら、電流値をプロットした。使用したセルを表に示す。6時間半印加したら実験を終了し、電圧を測定した。
キャパシタCVシミュレーション3.1節では、マンガン酸リチウム単体の評価をまとめたものである。水系電解液におけるマンガン酸リチウムの高速性を検証し、高速マンガン酸リチウムの高速性を発揮できる集電体の模索し、 マンガン酸リチウムの活性化過電圧を求めた。また、マンガン酸リチウムの粉体と集電体との抵抗の発現要因をまとめたものである。
表に,使用したマンガン酸リチウムの観察記録を示す。
| 試料名 | ID | 気が付いたこと | 写真・スケッチ |
|---|---|---|---|
| L191111 | 14426 | 他のマンガン酸リチウムよりも色が青かった | |
| L191114 | 14427 | ||
| L191118 | 14428 | ||
| L191121 | 14429 | ||
| L191122 | 14430 | ||
| L191125 | 14431 | ||
| L191206 | 14434 | ||
| L191209 | 14435 | ||
| 高速マンガン酸リチウム 粗粉 | 14447 | 微粉程粘着力がない。ビンを振ったら粉が少しガラス瓶の壁面に付く | |
| 高速マンガン酸リチウム 微粉 | 14448 | 粘着力がかなりあり、ビンを振っただけでガラスビンの壁面にくっ付いた。 | |
| 高速マンガン酸リチウム 900℃処理 | 14449 | 他のLMOをと違い、ガラス瓶を振るとガラスの壁面と当たってカランと音が鳴った | |
| 高速マンガン酸リチウム 850℃処理 | |||
| 高速マンガン酸リチウム | 14342 | ||
| KF-5 | 14273 |
高速マンガン酸リチウム,比較用マンガン酸リチウム,900℃処理,微粉,粗紛の粒度分布を図に示す。 高速マンガン酸リチウムは比較用マンガン酸リチウムに比べて、粒子径が小さいのが多い。 900℃処理を施した高速マンガン酸リチウムの粒子径は比較用マンガン酸リチウムより大きい。
Al箔とb箔に活物質打ち込んだ時の様子を表に示す。
| Al箔 | b箔 | |
|---|---|---|
| Ref-LMO | ||
| HS-LMO | ||
| LFP | ||
| LCO |
オシロスコープでピークが観測できた最大掃引速度とセルの内部抵抗を表に示す。高速マンガン酸リチウムのピークの見えた最大の掃引速度は比較用マンガン酸リチウムより、10倍の掃引速度でもピークが観測できた。 また、900℃処理を施した高速マンガン酸リチウムのピークが見えた掃引速度は10V/secで、他の高速マンガン酸リチウムと比べると掃引速度が遅い。 同様に微粉と粗紛でも違いは分からなかった。
| 試料名 | ID | n | 最大掃引速度 vmax /mV⋅s-1 | セルの内部抵抗 Ri /Ω |
|---|---|---|---|---|
| L191111 | 14426 | 1 | 20 V/sec | 1000 mV/s で55.5Ω |
| L191114 | 14427 | 1 | 20 V/sec | 1000 mV/s で50Ω |
| L191118 | 14428 | 1 | 20 V/sec | 1000 mV/s で120 Ω | L191121 | 14429 | 1 | 20 V/sec | 1000 mV/s で24Ω |
| L191122 | 14430 | 1 | 20 V/sec | 1000 mV/s で50Ω |
| L191125 | 14431 | 1 | 20 V/sec | 1000 mV/s で60Ω |
| L191206 | 14434 | 1 | 20 V/sec | 26Ω |
| L191209 | 14435 | 1 | 20 V/sec | 75Ω |
| 高速-LMO-003 粗粉 | 14447 | 1 | 20 V/sec | 40 Ω |
| 高速-LMO-003 微粉 | 14448 | 1 | 20 V/sec | 33 Ω |
| 高速-LMO-003 900℃処理 | 14449 | 1 | 10 V/sec | 42 Ω |
| 高速マンガン酸リチウム | 14342 | 1 | 20 V/sec | 26 Ω |
| 比較用マンガン酸リチウム | 14273 | 1 | 2 V/sec | 18 Ω |
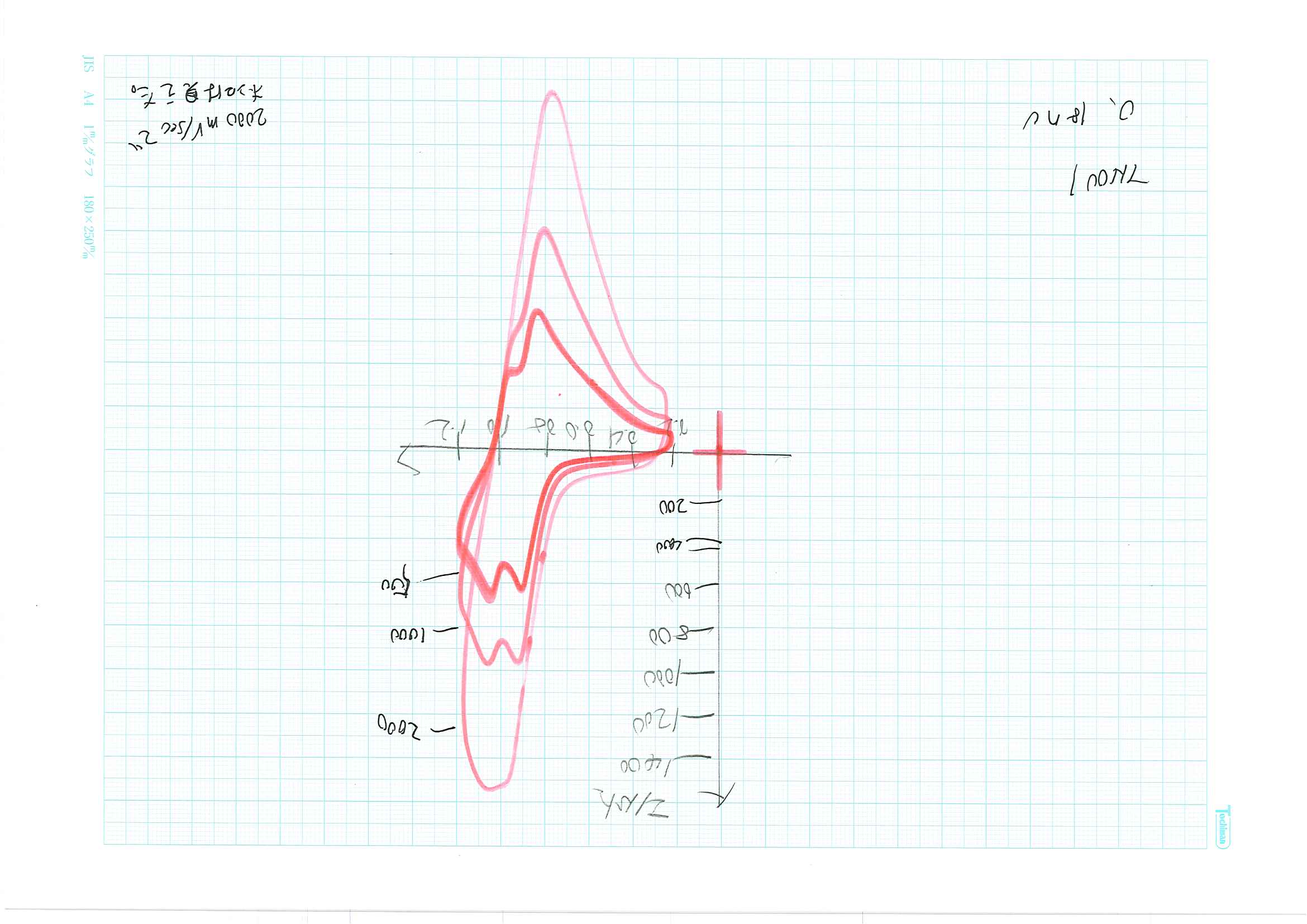
高速マンガン酸リチウムのサイクリックボルタモグラム示す。
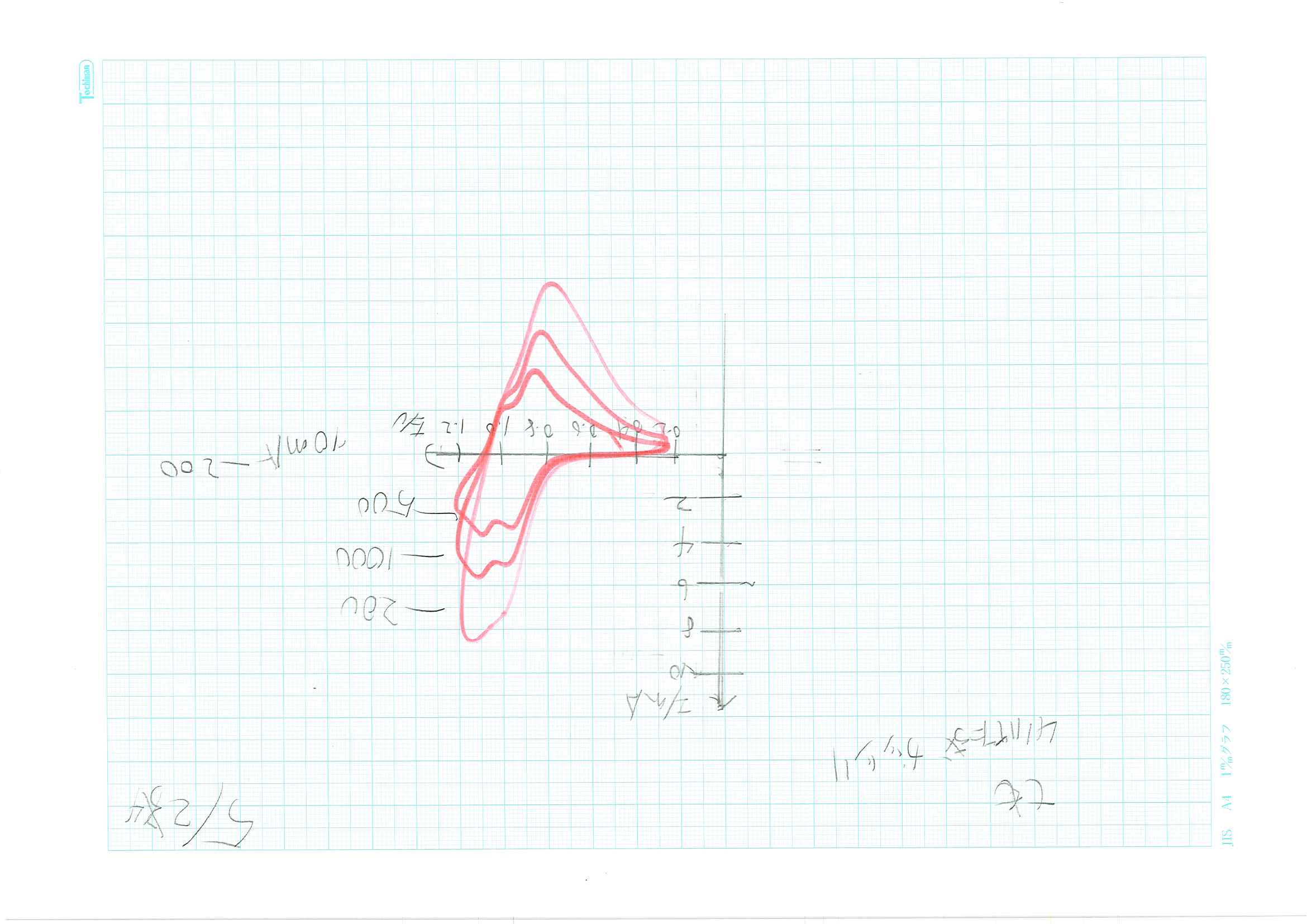
比較用マンガン酸リチウムのサイクリックボルタモグラム示す。
水に浸漬した高速マンガン酸リチウムのサイクリックボルモグラムと高速マンガン酸リチウムのサイクリックボルタモグラム示す。1000mV/secの時、水の浸漬にしてないマンガン酸リチウムで観測できたカソードピークが消えた。

水に浸漬した比較用マンガン酸リチウムのサイクリックボルタモグラムと水に浸漬してない比較用マンガン酸リチウムのサイクリックボルタモグラムを示す。 1000mV/secの時、両方のセルでサイクリックボルタモグラムのピークが確認できなかった。

アルミニウム箔にリン酸鉄リチウムを打ち込んだ時ののサイクリックボルタモグラムを示す。OCPから掃引速度5 mV/secで掃引すると0.40 Vで420μAのピークが現れた。カソード側では0.24 Vで-330μAのピーク電流が現れた。サイクルを繰り返すとピーク電流が小さくなった。
b箔にリン酸鉄リチウムを打ち込んだ時ののサイクリックボルタモグラムを示す。OCP=0.096 Vから掃引速度5 mV/secで掃引すると0.43 Vで130 μAのピークが現れた。カソード側では0.25 Vで-120μAのピーク電流が現れた。サイクルを繰り返しても、ピーク電流に変化は見られなかった。
高速マンガン酸リチウムは比較用マンガン酸リチウムに比べて、10倍の速度で対応できる。また、高速マンガン酸リチウムをふるい分けしても、マンガン酸リチウムの速い掃引速度に対応できる高速性に影響は少ない。しかし、水に浸漬したら、高速マンガン酸リチウムの高速性が損なわれる。
この項では、マンガン酸リチウムと電解液中での相性をCVで模索した。
顕微鏡観察の結果高速性は金に対して6割り近く付いており、比較用は金に対して3~5割り程度付いていた。
10μAで充電したとき、1.2Vにまでに掛かった時間は比較用が80sで高速性では320sだった。モニターを見ていたが、両方とも自己放電してなかった。
過電圧と電流密度のターフェルプロットのデータを図aに示した。高速性マンガン酸リチウムのSOC=90%で放電時のターフェルプロットの傾きが-になっていた。充電時を比べると高速性と比較用では高速性の傾きが比較用よりも2倍大きかった。放電時も90%のターフェルプロットを除けば同様である。切片は充電時は高速性の方が小さく、放電時はSOC=50%の時は高速性は小さく、SOC=70%の時は比較用のほうが小さかった
充電時のターフェルプロットから求めたマンガン酸リチウムの傾きと切片を示す。 高速マンガン酸リチウム打ち込み電極の傾きはSOCによって大きく変化するのがわかる。 一方、KF-5はSOCによっての変化は小さく、高速と比べて、傾きも小さいのが分かる。
| SOC | a(mV) | b(mV) |
|---|---|---|
| 比50% | -4.1 | 15.6 |
| 比70% | -0.1 | 12.4 |
| 比90% | -0.1 | 12.4 |
| 高速性50% | -5.2 | 27.6 |
| 高速70% | -10.7 | 45 |
| 高速性90% | -25.5 | 120.6 |
放電時のターフェルプロットから求めたマンガン酸リチウムの傾きと切片を示す。SOCが90%の時、高速マンガン酸リチウムの傾きが、比較用マンガン酸リチウムに 比べて低い。しかし、SOCが70%,50%の時は傾きが比較用のほうが小さい。
| SOC | a(mV) | b(mV) |
|---|---|---|
| 比50% | 3.1 | 10 |
| 比70% | 0.9 | 9.2 |
| 比90% | -0.4 | 32.8 |
| 高速性50% | -1.5 | 22.2 |
| 高速性70% | 2.2 | 22.8 |
| 高速性90% | 11.1 | -1.8 |
アルミニウムを集電体にした時のクロノアンペログラムを図に示す。
Al-b箔にマンガン酸リチウムを打ち込んだ時のクロノポテンショグラムを図に示す。
アルミニウム箔に高速マンガン酸リチウムを打ち込んだ時の電極のクロノポテンショグラムを示す
b箔に高速マンガン酸リチウムを打ち込んだ時のクロノポテンショグラムを示す
クロノポテンショメトリーの過電圧から読み取った内部抵抗を表に示す。比較用マンガン酸リチウムは集電体に表面処理を施す事で、内部抵抗を小さくすることができた。しかし、高速では内部抵抗が大きくなった。しかし、充電終了時には内部抵抗はb箔を使用した物が小さくなった。また、充電率が大きくる程、内部抵抗が下がる傾向が見えた。
| 充電開始時の内部抵抗 kΩ | 充電終了時の内部抵抗 kΩ | 放電開始時の内部抵抗 kΩ | |
|---|---|---|---|
| 11 | 6 | ?? | |
| b-比較 | 1.75 | ?? | 0.25 |
| Al-高速 | 0.75 | 8.25 | 7.5 |
| b-高速 | 3.75 | 0.75 | 4 |
アルミニウムにリン酸鉄リチウムを打ち込んだ時のクロノポテンショグラムを示す。OCPは0.308Vだった。
上図のクロノポテンショグラムの充電開始直後を拡大した図を示す。40μAの電流を加えるとOCP0.308Vから50m秒には0.321Vまで上昇した。この時過電圧と電流をオームの法則で計算すると抵抗は325Ωになった。
クロノポテンショグラムの放電開始直後を拡大した図を示す。40μAで通電すると0.318Vから0.312Vまで下降した。この時過電圧と電流をオームの法則で計算すると抵抗は150Ωになった。
アルミニウムb箔にLFPを打ち込んだ時のクロノポテンショグラムを示す。
充電開始直後のクロノポテンショグラムを示す。40μAを通電すると OCP=0.337Vから0.359Vまで上昇した。オームの法則から求めた内部抵抗は550Ωだった。
放電開始開始直後のクロノポテンショグラムを示す。放電開始前の電位は0.339Vで放電を開始した直後は0.331Vまで下降した。オームの法則から求めた内部抵抗は200Ωになった。
テスターで求めた面積当たりの抵抗を表3に示す。リン酸鉄リチウムの接触抵抗は他の活物質に比べて抵抗が小さい。
| 高速マンガン酸リチウム | 比較用マンガン酸リチウム | リン酸鉄リチウム | コバルト酸リチウム | |
|---|---|---|---|---|
| Al | 600kΩ | 10MΩ | 4Ω | |
| Al-b | 16kΩ | 8kΩ | 2Ω | 17kΩ |
| Ni | 20kΩ | 20kΩ | ||
| Au | 1Ω | 1Ω | ||
| Ag | n=1 ,3MΩ n=2 ,1Ω |
12kΩ | ||
| Ti | 31kΩ | 9kΩ | 3Ω | 800kΩ |
| Cu | 12kΩ | 1Ω | 18kΩ | |
| 炭素担持箔 | 2Ω | |||
| CNT不織布 | 40Ω | 20Ω |
比較用マンガン酸リチウムを集電体で挟んだセルの電圧-電流密度曲線を図に示す。
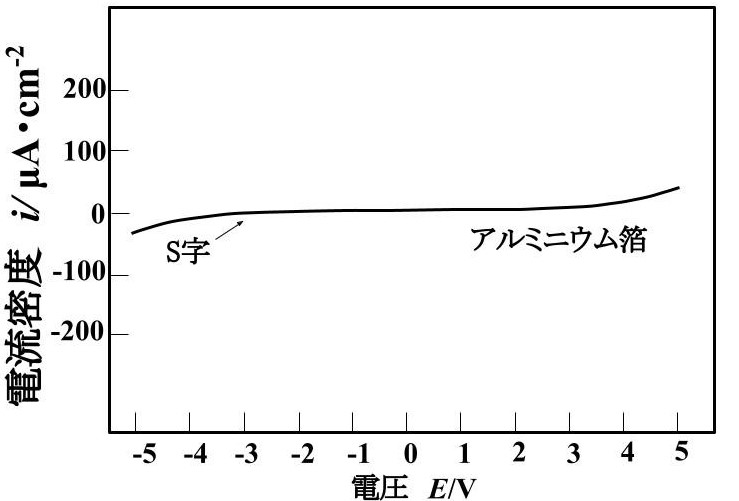
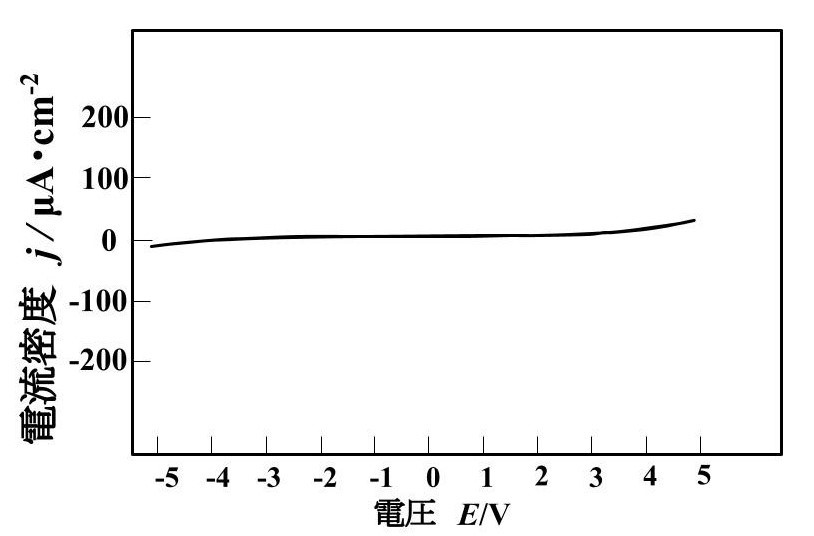
アルミニウム箔の集電体では、電圧-電流密度曲線が S 字曲線になり、非直線性を示した。相互拡散箔や炭素担持箔、炭素コート箔の集電体を使用したセルでは、電圧-電流密度曲線が直線になった。
マンガン酸リチウムとアルミニウム箔の面積当たりの抵抗 Rcは、電圧によって変化した。2V の面積当たりの抵抗 Rcは 1.7MΩ·cm2 であった。4Vの Rcは 0.2 MΩ·cm2 であった。
マンガン酸リチウムと相互拡散箔の面積当たりの抵抗 Rcは 2V でも 4V でも、接触抵抗率 Rcは0.04MΩ·cm2 で同じであり、変化しなかった。
比較用マンガン酸リチウムをb箔とAl箔で挟んだセルの電圧-電流曲線を示す。Al箔にリファレンスを接続した。電圧電流曲線はS字になった。また、アノード掃引時では電流が1Vで流れ始めたが、カソード掃引時では-2Vで電流が流れ始めた。また、Al箔で挟んだセルより、電流が流れた。
高速マンガン酸リチウムを集電体で挟んだ時の電圧-電流密度曲線を示す。 アルミニウム箔の集電体では、電圧と電流密度の関係が S 字曲線になり、非直線性を示した。相互拡散箔や炭素担持箔、炭素コート箔の集電体では、木の葉型になった。
マンガン酸リチウムとアルミニウム箔が接触すると面積当たりの抵抗 Rcは、電圧によって変化した。2V の面積当たりの抵抗Rcは 1.5MΩ·cm2 であった。4Vの Rcは 0.13MΩ·cm2であった。 相互拡散箔では、2V でも4Vでも面積当たりの抵抗 Rcは0.02MΩ·cm2となり、電圧によって抵抗に変化はしなかった。
高速マンガン酸リチウムをb箔とAl箔で挟んだセルの電圧-電流曲線を示す。b箔にリファレンスを接続した。電圧電流曲線はピークができる非対称なS字になった。アノード掃引時では1.5Vで電流が流れ始め、3Vで下降し、3.5Vから電流が大きくなった。カソード掃引時では-1.7Vで電流が流れ初め、-2.7 Vで電流が下降していき-3.5Vで再び電流が流れ始めた。
マンガン酸リチウムをCNT450で挟んだセルの電圧-電流密度曲線を図に示す。高速マンガン酸リチウムも比較用マンガン酸リチウムも金属集電体のセルに比べて電流密度は大きくなった。高速マンガン酸リチウムの電圧-電流密度曲線は少し膨らみが見えた。。
様々な集電体でマンガン酸リチウムを挟んだ時のサイクリックボルタモグラムを表に示す。アルミニウムに表面処理を施した箔では高速マンガン酸リチウムは膨らみが見えた。金箔やニッケルでも膨らみが見えた。アルミニウムやチタンではS字曲線になった。銅箔は直線になった。CNT450箔では拡大すると僅かに膨らんでるように見えた。皮革用マンガン酸リチウムでは膨らみが見えなかった。また、掃引速度を変えたとき膨らみの大きさに変化は見えなかった。この事からこの膨らみは静電容量による膨らみでは無いと考えられる。
| 高速 | 比較 | |
|---|---|---|
| Al |
|
|
| b箔 |
|
|
| CC箔 |
|
|
| TT箔 |
|
|
| CNT455 |
|
|
| CNTs |
|
|
| Au |
|
|
| Ni |
|
|
| Ti | ||
| Cu |
電圧-電流密度曲線の傾きから求めた、 2Vの時の各マンガン酸リチウムと集電体の面積当たりの抵抗を表に示す。
| 高速マンガン酸リチウムの接触抵抗 MΩ·cm2 | 比較用マンガン酸リチウムの接触抵抗 MΩ·cm2 | |
|---|---|---|
| Al | 1500 | 1700 |
| Al-b | 40 | 20 |
| CC | 20 | 15 |
| TT | 20 | 15 |
| Au | 15 | 25 |
| CNT不織布 | 0.13 | 0.8 |
| Ni | 17 | 50kΩ |
| Ti | 30 | |
| Cu | 100 | |
アルミニウムを集電体にした時の電圧-電流密度電圧曲線から 求めた接触コンダクタンスと電流密度の関係をプロットした図を示します。 コンダクタンスは、電流密度とともに増加した。
G とj の関係から傾きa を求めると、 マンガン酸リチウムでは、1.1 S/Aだった。 高速マンガン酸リチウムでは1.2 S/A と傾きはほぼ同じだった。
表に測定したセルの電圧-電流曲線を示す。-2℃を破線、40℃を実線で示す。アルミニウム箔で挟んだセルは温度が上昇すると、電流が流れやすくなった。Al-高速セルは Al-比較用セルと比べて、温度の影響を受けやすい。
b箔-高速セルは温度の影響はほぼ無かった。しかし、比較用-セルでは温度が高くなると電流の傾きが小さくなった。
| 比較 | 高速 | |
|---|---|---|
| Al |
|
|
| b箔 |
|
|
リン酸鉄リチウムをアルミニウム集電体に挟んだ時の電流密度-電圧曲線の結果を図に示す。マンガン酸リチウムに比べて、電流は1000倍大きく流れた。また、相互拡散箔を使用したセルは直線になったが、アルミニウムを使用したときのセルはマンガン酸リチウムとは逆のS字になった。
。
図に整流性が現れる電圧-電流密度曲線を示します。アルミニウムとマンガン酸リチウムは整流性と思われる曲線が現れたので、アルミニウムとマンガン酸リチウムはショットキー接触 と考えられる。 相互拡散箔や炭素担持箔やカーボンコート箔は電圧-電流密度曲線は直線になったので、オーミック接触すると考えられる。
図に集電体による電流の流れるイメージを示す。矢印は電流の様子です。 アルミニウムに表面処理を施したとき、接触抵抗は高極性マンガン酸リチウムの方がマンガン酸リチウムより大きい。 なので、接触抵抗は小野寺の式に従うので、マンガン酸リチウムとアルミニウムの接触抵抗は被膜抵抗に支配されており、
しかし、アルミニウムと電流密度とコンダクタンスの傾きでは高極性マンガン酸リチウムとマンガン酸リチウムの傾きは殆ど同じだった。 アルミニウムとマンガン酸リチウムの間の接触抵抗はショットキー接触が支配的と考えられる。
CNTの不織布では他の金属と比べて、小さい穴が無数にあるので、マンガン酸リチウムの接触点が他の集電体より多くなったため、電流が沢山流れたと考えられる。
高速マンガン酸リチウムで見えた膨らみの原因は静電容量によるものと考えられたが、掃引速度でその容量性に変化はなかった。この事から、この膨らみは静電容量によるものではなく、電圧と電流に対する応答であると言える。アルミニウムとマンガン酸リチウムのセルは、温度上昇と共にキャリアが増えたのでこれは半導体の挙動だと考えられる。また、降伏電圧の範囲が温度と共に狭くなった事から、ツェナ効果によるものだと推測する。 高速マンガン酸リチウムが温度上昇と共に電流が大きくなるのは、高速マンガン酸リチウムのエネルギーギャップを超えるキャリアが多い。
b箔-比較セルは福永らと同じく温度と共に傾きが小さくなったので、b箔-比較セルはオーミックコンタクトらしい挙動になった。
図にセロテープクリップセルのクロノアンペロメトリーの測定結果を示す。高速LMOをb箔で挟んだセルを黒の四角でプロットし、未処理箔で挟んだセルを白の四角でプロットし、近似曲線を黒の実線で示した。 比較用LMOをb箔で挟んだセル黒の丸でプロットし、未処理箔で挟んだセルを白の丸でプロットし、近似極線を黒の破線でプロットした。 高速マンガン酸リチウムは時間と共に電流が流れなくなった。2sで1400μAまで電流を流したが、急速に下がっていき、6時間半後で19μAになった。 未処理のアルミニウムで挟んだセルは、印加した2秒後のセルは100μAで流れた。60s後に237μA流れた。その後、下がっていき、24300s後には9.0μAまで下がった。 比較用マンガン酸リチウムを比較用LMOをb箔で挟んだ比較用bは流したら一瞬で347μAから直線に上昇してき、直線で下がっていった。 未処理のAl箔で挟んだセルは印加直後は30μAの電流が流れ、60s後に52μAまで上昇し、24300s後には23μAまで下がった。
クロノアンペログラムの結果から、各セルの始まりの面積当たりのコンダクタンスと一番電流が流れた時のコンダクタンスと終わりのコンダクタンスを表に示す
| 電池式 | 印加直後の抵抗 mS/m2 | ピーク時の抵抗 mS/m2 | 実験終了時の抵抗 mS/m2 |
| Al|比較用|Al | 27 | 46 | 20 |
| Al|b|比較用|b|Al | 308 | 338 | 216 |
| Al|高速|Al | 89 | 210 | 8 |
| Al|b|高速|b|Al | 1270 | なし | 17.8 |
6時間30分程印加してから、実験を終了してからの電圧の変化を表に示す。高速マンガン酸リチウムを使用したセルが電気を溜めてるのが分かる。
| セル名 | 印加前の電圧(OCV)V | 電流遮断後の電圧 V | 電流遮断から3分後の電圧 v | |
| 比較用-a | 0.00 | 0.6 | 0.3 | |
| 比較用-b | 0.00 | 0.09 | 0.03 | |
| 高速-a | 0.00 | 3.1 | 1.5 | |
| 高速-b | 0.00 | 1.8 | 1.13 |
温度を加熱した時の変化を示す。
HS-bセルは印加前は24℃から、印加後は24℃だった。LCO-Alセルは24℃から、29℃に上がった。LFP-bセルは32℃まで上昇した。また、印加終了時、集電体の周りとゼムクリップが 当ててある中央部から冷め始めた。LFP-bセルでは集電体と活物質の接触場所より、中央の活物質と活物質の接触場所が熱を持っていた。
3.2節では粘土水分散液による水の電気分解への影響や、粘土水分散液の不思議な特徴について纏め。 リチウムイオン電池材料への可能性について検討した。
図に電解液にモンモリロナイトLi水分散液を使用したセルのサイクリックボルタモグラムを実線、水酸化リチウム水溶液を使用したセルのサイクリックボルタモグラムを破線で示す。作用極にはリン酸鉄リチウムを使用した。 縦軸に電流 I/μAをプロットした。横軸に銀塩化銀電極に対する電位 E/ Vをプロットした。 導電率はモンモリロナイトLi水分散液が低いのにも関わらず、ピーク電流はモンモリロナイトLi水分散液の方が大きかった。
モンモリロナイトLiLi水分散液を 自然電位 0.1Vからアノード掃引を行うと、電位が0.3Vで電流値71.6uAのピーク電流を示した。 さらに、アノード掃引を続け、0.8Vでカソード掃引に反転した。 電位が-0.09Vでカソードピークとなり、電流値は-56.8uAであった。
電解液に、水酸化リチウム水溶液を使用したセルのサイクリックボルタモグラムを破線で示す。導電率は6.0mS/cmだった。 自然電位 0.09Vからアノード掃引を行い、電位が0.25Vで電流値63.8uAの電流ピークを示した。 さらに、アノード掃引をつづけ、電位が0.8Vで反転した。 電位が-0.05Vでカソードピークとなり、電流値は-46.9uAであった。
図に電解液にスチーブンサイト水分散液を使用したセルのサイクリックボルタモグラムを実線、水酸化リチウム水溶液のサイクリックボルタモグラムを破線で示す。作用極にはリン酸鉄リチウムを使用した。 縦軸に電流 I、単位 uAをプロットした。横軸に銀塩化銀電極に対する電位 E,単位 Vをプロットした。
スチーブンサイトの導電率が低いのにも関わらず、流れたピーク電流は同じくらいだった。
スチーブンサイト水分散液の導電率は1.4mS/cmであった。 自然電位 0.06Vからアノード掃引を行い、電位が0.18Vで電流値2.5uAのピーク電流を示した。 さらに、アノード掃引を続け、0.6Vの電位で反転した。 電位が0.02Vでカソードピークとなり、電流値は-2.0uAであった。
電解液に、水酸化リチウムを使用したCVを破線で示す。導電率は6.0mS/cmだった。 自然電位 0.062Vからアノード掃引を行い、電位が0.15Vで電流値2.5uAのピーク電流を示した。 さらに、アノード掃引を続け、0.8Vの電位で反転した。 電位が0.00Vでカソードピークとなり、電流値は-2.4uAであった。
図に電解液のリチウムイオンを含まないモンモリロナイト水分散液を使用したセルのサイクリックボルタモグラムを実線、硫酸ナトリウム水溶液のサイクリックボルタモグラムを破線で示す。
モンモリロナイト水分散液を使用したセルはリチウムイオンを含まないのにも関わらず、カソードピークが確認できた。しかし、硫酸ナトリウム水溶液ではカソードピークが確認できなかった。
電解液に、モンモリロナイト水分散液の導電率は0.8mS/cmであった。 自然電位 0.08Vからアノード掃引を行い、電位が0.55Vで電流値250uAのピーク電流を示した。 さらに、アノード掃引を続け、0.8Vの電位で反転した。 電位が-0.10Vでカソードピークとなり、電流値は-60uAであった。
硫酸ナトリウム水溶液の導電率は未測定。 自然電位 0.081ボルトからアノード掃引を行い、電位が0.38Vで電流値70uAのピーク電流を示した。 さらに、アノード掃引を続け、0.8Vの電位で反転したがカソード側にピークは見られなかった。
粘土水分散液および水酸化リチウム水溶液中の活物質 のサイクリックボルタモグラムのアノードピークの拡大図を示す。 縦軸に1サイクル目と2サイクル目のアノードピークの電流増加率、横軸に銀塩化銀電極に対する電位をプロットした
どちらの電解液も2サイクル目のピーク電流が1サイクル目のピーク電流より大きくなった。しかし、粘土水分散液は水酸化リチウムに比べて電流増加率が2倍になった。
粘土水分散液を使用する事で、リチウムイオンの移動度が上昇した。赤間らはPVdFでは、水系電解液中でバインダーが電解液により膨潤し、イオンの移動を助けている可能性が見いだされたと述べている。(第58回電池討論 水溶液系電池のためのバインダーの イオン透過性の インピーダンス測定による評価 )
田邉らの報告によるとヘクトライト2wt%水分散液を分極すると、高い粘性を有する層の生成を制御できると述べている。 37 )
スチーブンサイトやモンモリロナイトでもこの層ができると考えると、この層が活物質から抜けたリチウムイオンを電極近傍に留めていると考えられる。
水酸化リチウム溶液では活物質が付着している部分が、付着してない部分より気泡の発生が早かった理由としては
活物質が触媒となって水の電気分解を促進していると考えられる。
粘土水分散液で分極した電極では、電極に層を形成し、電気分解の発生を抑える事が考えられる。
この粘土層はリチウムイオンの輸率を上げて、水酸化物イオンの輸率を下げる可能性がある。 図にサイクリックボルタンメトリーで測定した後のスティーブンサイト-Li2wt%/水分散液の場所と導電率を示す。
電極近傍の導電率が上がり、バルクの導電率が下がった。
電極近傍の導電率が1.6 mS/cm、バルクの導電率が0.9 mS/cm、SUS電極に付着していたスティーブンサイト-Li2wt%/水分散液だった。
表にスチーブンサイト-Li2wt%/水分散液を時間毎による導電率と観察記録を表に示す。
時間が経つに連れて、流動性がなくなり、導電率が上昇した。
スティーブンサイト-Li2wt%/水分散液の時間毎による導電率と観察結果
セロテープクリップセルの測定で、集電体と活物質の接触抵抗が分かった。アルミ箔とマンガン酸リチウムの接触抵抗は、表面処理によって大きく変わったが他の活物質では接触抵抗による大きな違いは見られなかった。 また、内部抵抗は接触抵抗が小さくなると小さくなる傾向が見えた。Al-b箔と活物質の接触抵抗はほぼ0と推測できる。接触抵抗と3極式セルの内部抵抗には相関関係があるように見えた。また、Al-b箔を使用すると接触抵抗が無視できる事から、b箔を使用したときに現れる内部抵抗は活物質の充放電反応抵抗、リチウムが活物質内の拡散による抵抗、活性化エネルギーによる抵抗が考えられる。 カーボンナノチューブの不織布を使うと接触抵抗を小さくする事ができる。
粘土水分散液は分極する事で電極近傍に層を形成する。その層は、リチウムイオンの輸率を上げて、水酸化物イオンの輸率を下げる機能がある。また、粘土水分散液は粘性が上がると共に導電率が上昇する事から、粘土にはリチウム電池の内部抵抗を下げる可能性がある。
リン酸鉄リチウムを金線に打ち込んで電極を作成します。そして同じモル濃度にした(1wt%=41mM)の水酸化リチウム及び(41mM)の硫酸リチウムを電解液にして、作用極を打ち込み電極,対極をSUS430,基準電極を銀塩化銀電極にし、ファンクションジェネレーターに接続したポテンショスタットでサイクリックボルタモグラムを行った。 電解液を硫酸リチウム(0.5M,pH=5.35)にした時のCVを図に示した。2サイクル目でピーク電流が大きくなった。OCV0.188Vからアノード掃引を行うと0.31Vで70μAのアノードピークが現れた。その後、カソード掃引を行っていくと0.12Vで-70μAのピークが現れた。2サイクル目ではアノードピークは0.29Vで83μAのピークが現れた。カソードピークは0.13Vで-72μAになった。
導電率はCV測定の前は34.3mS/cmだったが、CV測定後には42.3mS/cmに
電解液を水酸化リチウム(0.46M,pH=13.3)にした時のCV測定図を図2に示した。硫酸リチウムとは違い、2サイクル目からピークが小さくなった。OCV0.01Vからアノード掃引を行うと0.31Vで65μAのアノードピークが現れた、カソード側では0.12Vで-54μAのカソードピークが現れた。2サイクル目のアノードピークは0.30Vで58μA,カソードピークは0.12Vで-38μAだった。
導電率はCV測定前は70.4mS/cmだったが、CV測定後は62.5mS/cmに変わった。 濃度を10倍に薄めた硫酸リチウムのCV測定図を図3に示した。アノードピークは0.22Vで9μA、カソードピークは0.09Vで-8μAのピークが現れた。 濃度を10倍に薄めた水酸化リチウムのCV測定図を図4に示した。2サイクル目でピークが大きくなった。アノードピークは0.28Vで58μA、カソードピークは0.09Vで-58μAのピークが現れた。2サイクル目はアノードピークは0.25Vで65μA、カソードピークは0.09Vで-50μA
モル濃度とピーク電位の関係を片対数グラフにプロットした物を図5に示した。〇はアノードピークで×はカソードピークである。モル濃度が上がる事で、アノードピーク、カソードピーク共に上がっていった。また、pHの変化はなかった。
電解液の濃度が高くなるとピーク電位が大きくなった。
3.2.3.粘土水分散液と粘性変化と導電率の上昇
3.2.3.粘土水分散液と粘性変化と導電率の上昇
時間 導電率 κ/mS/cm 観察記録
0分,No.1 1.6 水混入 5分,No.1 1.85 水混入 20分,No.1 1.87 水混入 30分,No.1 2.09 (実験方法変更、放置),水面だけ動く感じ 80分,NO.1 2.14 60度傾けても動かない 130分,NO.1 2.22 90度傾けても動かない 210分,NO.1 2.38 180度傾けても動かない 240分,NO.1 2.51 180度傾けても動かない 0分,NO.2 2.05 60分,NO.2 2.12 水面の上部だけが動く感じ 105分,NO.2 2.17 水面の上部だけが動く感じ 190分,NO.2 2.29 水面の上部だけが動く感じ
4.結言
参考文献
文献
学会発表
マンガン酸リチウム粒子の表面極性によるアルミニウム集電体との接触状態の変化
.
表面技術協会 第144回講演大会, オンライン開催. 2021/09/16
粘土/水分散液を担持した電極での電池正極材料の充放電
.
第61回電池討論会,オンライン開催,2020/11/18
電池正極材料表面近傍での粘土分散液中のカチオン移動
.
表面技術協会 第143回講演大会, オンライン開催. 2021/03/04.
LFPの電解液の反応電位のCV
名前 数量 ID 備考 金線 少量 13625 備考 リン酸鉄リチウム 少量 10016 備考 水酸化リチウム 10ml 14506 備考 硫酸リチウム 10ml 14507 備考 圧着端子 1つ 備考 旗方にカットしたSUS430 1枚14337 備考 ポテンショスッタット 1つ 337 HOKUTOー151 X-Yレコーダー 1つ 1895 備考 ファンクションジェネレーター 1つ 197 備考 実験結果





まとめ