電解の際、カソード反応が亜鉛金属の析出反応、アノード反応が酸素発生反応となる。カソードのスターティングシートとしては析出亜鉛剥離性のよいアルミ板が、アノードとしては鉛あるいは鉛合金が使用されている。電解法の特徴として大量生産には不向きであるが、小規模生産には、取り扱いが容易である点を含めて適した製法となる。 表5.7には主要な電解採取プロセスの例を示す。電解液としては硫酸塩が主体であるが、カソード生成物の表面性状が良好であることが必要で、にわかなどの添加剤が入れられる。
| 金属 | Zn | Co | Mn | Cr |
|---|---|---|---|---|
| 電解液 | ZnSO₄+H₂SO₄ | CoSO₄+H₂SO₄ | MnSO₄+(NH₄)₂SO₄+H₂O | NH₄Cr(SO₄)₂+H₂SO₄ |
| 温度 | 40 | 55 | 35~40 | 53 |
| 槽電流 | 42 | 10~16 | 7.5 | 16 |
| 電流密度 | 80~480 | 125~200 | 270 | 750 |
| 単槽電圧 | 3.3 | 3.5 | 4.7 | 4.2 |
| 電流効率 | 90 | 83 | 60~63 | 45 |
| 電解電力 | 3000 | 4200 | 8000 | 16500 |
| その他 | - | - | 隔膜あり | 隔膜あり |
(2)電解精製
乾式製錬で得られた粗金属を鋳込んだアノードを用い、目的金属と同一の金属塩を含む浴を電解液として電解し、カソード上に純度の高い金属を析出させる方法を電解精製という。 図5.6には銅を例とした電解精製の原理図を示す。電極の間に大きな電位差を与えなければ、原料のアノードに含まれる不純物のうち、その溶解電位が目的金属より貴(イオン化傾向が小)なものは溶解せずに アノード上に残るか沈殿物(アノードスライム)となる。このスライムの中には金、銀、白金といった効果な貴金属が含まれており、別行程で回収される。目的金属より卑な電位(イオン化傾向が大)の不純物は溶出するが、 カソードには析出せず、溶液中に残る。目的金属と溶解電位が近いものは分離が困難となるので、予め分離しておく。工業的には銅が代表的で生産量も多い。その他、水溶液電解でスズ、銀、白金などの貴金属、ニッケル、鉄、鉛、アンチモン、スズ、ビスマスなどで行われている。 溶融塩を電解質として用いたものでは三層電解法によるアルミニウムが実用化しているほか、プルトニウム、鉛、ウランなどについても考えられている。
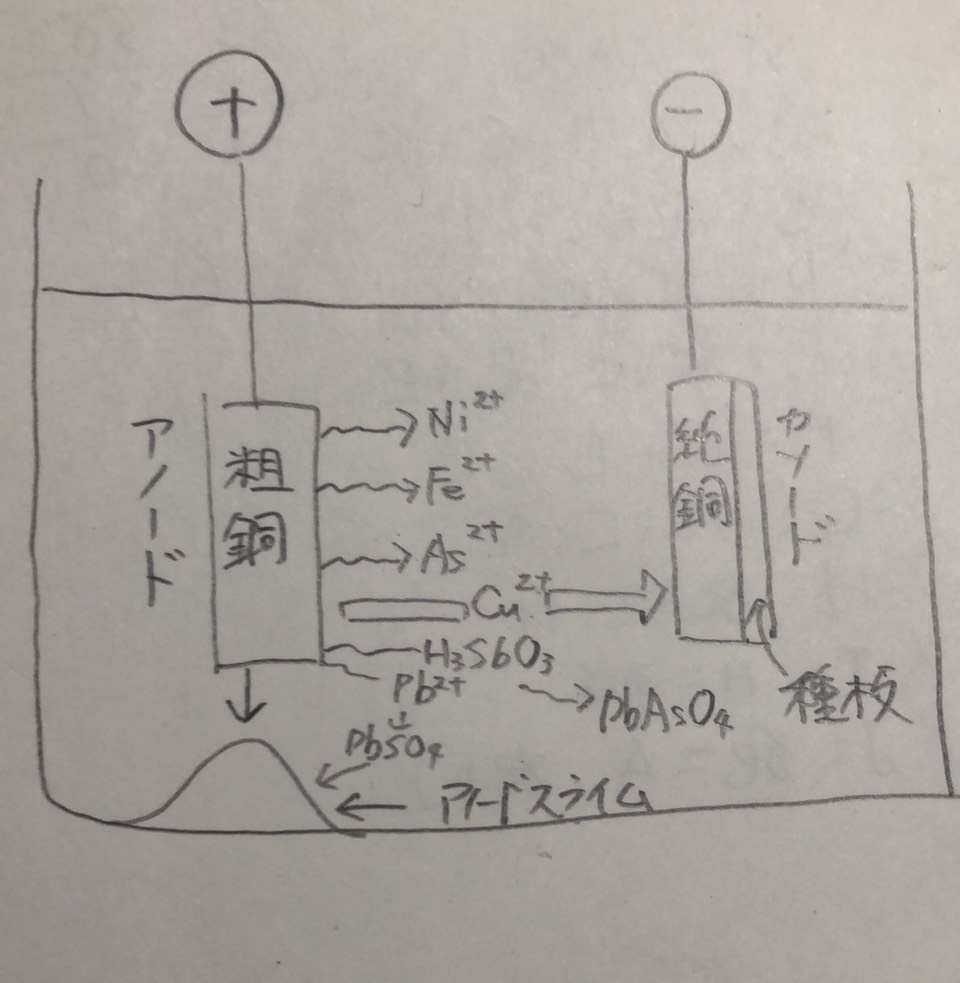
表5.8には電解精製プロセスの例を示す。目的金属がカソード上に平滑、緻密に析出することが望ましく、それに適した電解条件、電解液が選ばれる。そのために、電解液に添加剤が入れられることが多く、にかわはその代表である。
| 金属 | Cu | Pb | Ag | Au | Ni |
|---|---|---|---|---|---|
| 電解液 | CuSO₄+H₂SO₄ | PbSiF₆+H₂SiF₄ | AgNO₃+HNO₃ | HAuCl₄+HCl | NiSO₄+H₃BO₃+NaCl |
| 温度 | 60 | 常温 | 常温 | 50~90 | 60 |
| 電流密度 | 220 | 147 | 314 | 200 | |
| 単槽電圧 | 0.31 | 0.46 | 1.7 | 1.9 | |
| 電波効率 | 97 | 93 | 93 | 95~99 | 93 |
| 電解電力 | 284 | 180 | 500 | 300~400 | 1900 |
5.3 溶融塩電解
5.3.1 溶融塩電解の概要
溶融塩とは常温で固体の塩を高温にして、融解させたものをいうが、イオン結晶をなす塩は融解してイオン伝導性を示し、電気化学システムの電解質となる。塩の種類により室温より1200℃の範囲で用いられるが、塩の分解電圧、蒸気圧が安定性 を評価する上で重要となる。ここでは水を使用しないのでフッ素発生のような酸素発生より貴な反応、アルミニウム還元の様な水素発生より卑な反応を起こすことができる。溶融塩電解は高温のシステムが可能で電解質の電導度が上昇するので、反 応が容易に進み、電極触媒に対する負担が小さいという利点がある。反面、高温では装置材料にかなりの制約が課されるといった欠点もある。工業電解とし は水溶液電解では製造不可能な金属の製造を中心に利用されている。リチウム、アルカリ金属、マグネシウム、カルシウムのアルカリ土類金属、アルミニウム、希土類金属、フッ素などが溶融塩電解で得られる代表的なものである。表5.9にはこれら溶融塩電解の主要なプロセスの諸元の例を示す。金属は液体の状態で生成させ、カソードとして利用したり、取り出しを容易にすることが多い。したがって浴の温度は金属の融点以上となり、それに適した塩が選ばれる。具体的にはハロゲン化物が多く用いられる。
| 製品 | Li | F | Na | Mg | Al | Ca | Mm |
|---|---|---|---|---|---|---|---|
| 原料 | LiCl | HF | NaCl | MgCl₂ | Al₂O₃ | CaCl₂ | MmO |
| 電解浴 | LiCl-KCl | KF-HF | NaCl-CaCl₂ | MgCl₂-NaCl-CaCl₂ | Na₃AlF₆-AlF₃-CaF₂ | -CaCl2 | MmF₃=LiF-BaF₂ |
| アノード材料 | 炭素 | 炭素 | 黒鉛 | 黒鉛 | 炭素 | 黒鉛 | 黒鉛 |
| カソード材料 | 鋼 | 鋼 | 鋼 | Mg(鋼) | Al(炭素) | 鋼 | Mm |
| 温度 | 450 | 85 | 590 | 700 | 970 | 800 | 900 |
| 槽電流 | 1.4 | 5 | 38 | 100 | 200 | 1.4 | 10 |
| 単槽電圧 | 6.8 | 10 | 6.9 | 6 | 4.0 | 25 | 10 |
| 電流効率 | 80 | 93 | 83 | 80 | 90 | 50 | 85 |
| 電解電力 | 36 | 16 | 10.6 | 17 | 13.4 | 67 | 11 |
| その他 | 隔膜あり | 隔膜あり | 隔膜あり | - | - | - | - |
5.3.2 アルミニウム製錬
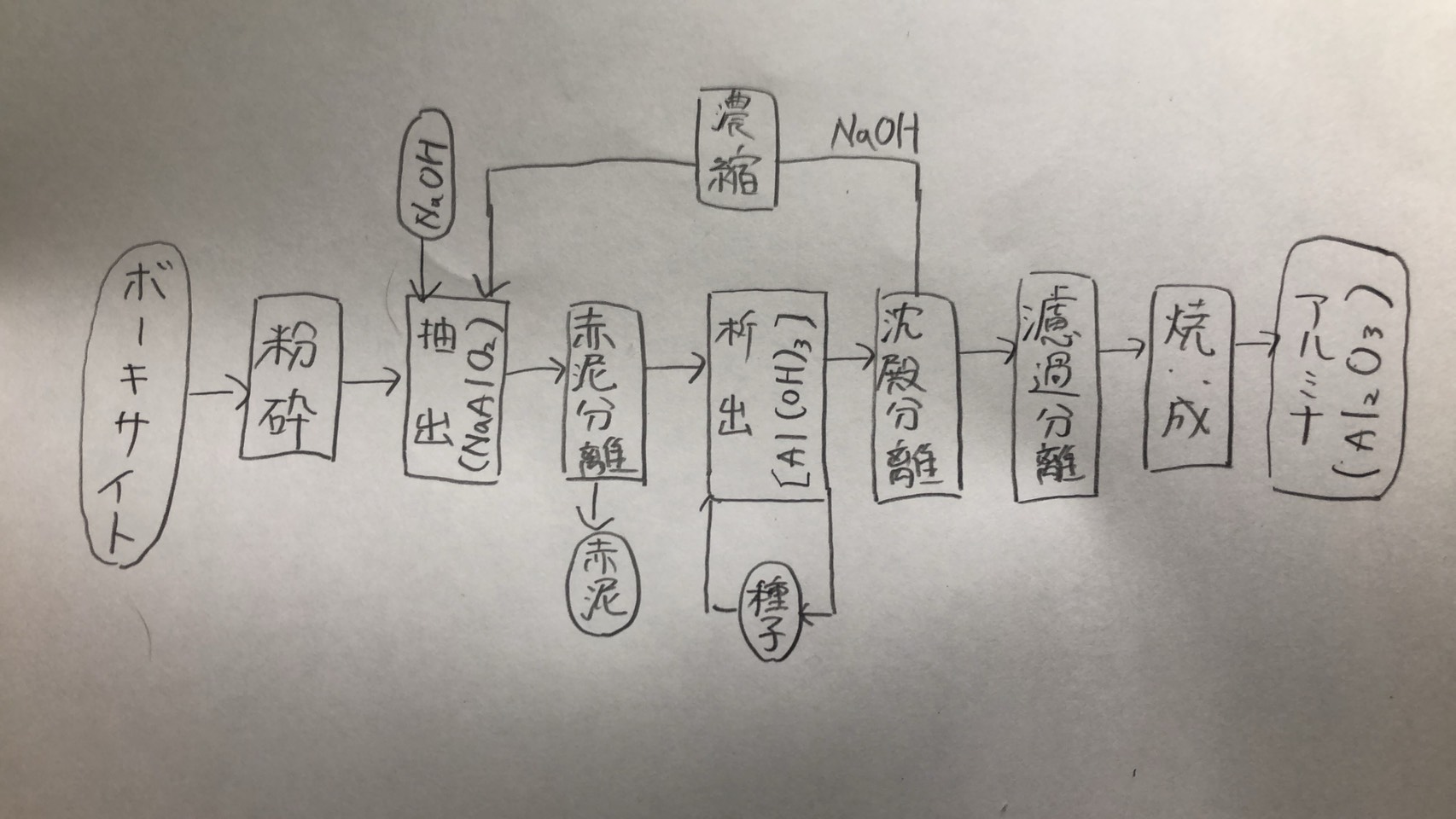
アルミニウムの原料はアルミナ(Al₂O₃)であり、ボーキサイトを水酸化ナトリウムで処理して不純物の酸化鉄、酸化ケイ素を除き、生成する水酸化アルミニウムを焼成して得られる。 これはバイヤー法と呼ばれるが図5.7にその流れを示す。
氷晶石(Na₃AlF₆)を主体とする電解浴中に、融点を下げるためAlF₃、CaF₂を添加し、970℃で、バイヤー法で得られたアルミナを5~8%溶かして電解する。これは1886年アメリカ人Hallとフランス人Heroultが別個に開発したものであるが、この開発者にちなんで ホール・エルー法と呼ばれる。反応は次の通りである。
アノードに炭素、カソードには生成したアルミニウムを利用するが、アノードの炭素が電気化学的に消費されながら反応は進む。理論的にはアルミニウム1tにつき330kgの炭素が必要だが、実際には400~450kg消費される。 この定量的に消費される炭素の補給方法に二通りある。プリベーク(既焼成)式では別な炉で炭素電極を焼成している。ゼーダベルグ(自焼成)式では電解炉に直接炭材を補給し、炉から放出される熱を利用して焼成する。 図5.8にはこれらの電解炉の構造を示す。
アルミニウムを工業的に生産する方法としては、このホール・エルー法が現状では唯一である。我が国では電力コストが高く、国内における直接生産はわずかであり、もっぱら電力の安い場所で作られる地金の輸入にたよっている。