化学実験Ⅰ エネルギー化学実験 2.電池の起電力と分解電圧
19512005 近純也
目的
電気化学の基本事項である「電池の起電力」と「分解電圧」について実験で確かめる。電池の起電力の実験ではダニエル電池を組み立てて電位差計で確かめる。分解電圧の実験では水電解に必要な電圧を確かめる。
電池の起電力について
目的
銅電極と亜鉛電極を作り、塩橋でつないでダニエル電池を組み立て、電位差計でダニエル電池の起電力を確かめる。次に銀塩化銀電極作り銅電極と亜鉛電極の単極電位を電位差計で確かめる。混合比を変えた鉄イオン(Ⅱ)と鉄イオン(Ⅲ)の溶液を作り、白金を作用極として、銀塩化銀電極に対する電位を測り濃度比の対数に対して電位をプロットし、ネルンストの式に従うかどうか確かめる。
使用器具
| 名称 | 個数 |
|---|---|
| 10mLビーカー | 3 |
| 秤量瓶 | 1 |
| ノギス | 1 |
| ガラス棒 | 1 |
| 洗瓶&イオン交換水 | 1 |
| ゼムクリップ | 1 |
| スパチュラ | 1 |
| セロハンチューブ | 1 |
| セロハンテープ | 1 |
| ミノムシコード(赤黒) | 各2本 |
| 電池ボックス | 1 |
| 単3電池 | 1 |
| 電子天秤 | 1 |
| 精密天秤 | 1 |
| ダブルクリップ | 2 |
| デジタルテスター | 1 |
| 抵抗尺(6V) | 1 |
| 検流計 | 1 |
| 紙やすり | 1 |
使用試薬
| 名称 | 式量 | 使用量 |
|---|---|---|
| 塩酸 | 36.46 | 10mL |
| 濃硝酸 | 63.0 | 3M |
| 塩化カリウム | 74.55 | 20mL |
手順
基準電源の作成とエレクトロメータの較正(こうせい)
実験テキストp17の上図のように基準電源を作成した。基準電源は、グラウンド端子に対して 1.0V の 電圧が出力された。この基準電源を標準電池として、抵抗尺の目盛りを較正した。
 |
ダニエル電池の電圧の測定
電池式 Cu|0.01 mol・dm-3 Cu2+||0.01 mol・dm-3 Zn2+|Zn のダニエル電池を作製した。基準電 源で較正した抵抗尺を用いて、ポッゲンドルフの補償法に従ってダニエル電池の電圧を測定した。 ネルンストの式を用いてできるだけ正確にダニエル電池の起電力を計算した。計算した起電力と ダニエル電池の実際の電圧を比較した。ダニエル電池の起電力を直接エレクトロメータに入力し、 その出力が抵抗尺の同じ目盛りに対応することで、エレクトロメータの動作を確認した。
銀Ⅰ塩化銀電極(基準電極)の作成とダニエル電池の単極電位
電気化学セルを組み立てて銀線を塩酸中でアノード酸化して 1 本だけ作った。
まず、銀線を紙やすりで研磨し、清浄な金属面を露出させた。その金属面を 3M HNO3で 前処理し、水洗いした。その電極で以下のセルを作成し、0.8mA/cm2 で 15 分ほど電解し、表面 に塩化銀を析出させた。電解セルには 10mL ビーカーを使った。転倒防止のため電解液を注ぐ 前に底に両面テープを貼っておき、電解液を注ぎ終わったビーカーは実験台にしっかり固定した。 電極はダブルクリップで固定した。同じ手順でもう一本作成した。2本の電極を飽和KCl溶液に浸漬し電池を 作成し、電位差をデジタルテスターで確認した。ここで、電位差が5mV以内であることを確かめた。10mLビーカー を2個用いて塩橋で接続した。銀Ⅰ塩化銀電極の標準電極電位を計算した。
結果
・基準電源を標準電池として抵抗尺を校正できた。このときの抵抗尺の目盛りは42 cmであった。
以下の図2に完成した基準電源の写真を示した。
 |
・基準電源と抵抗尺を使ってダニエル電池の起電力を測定した。
起電力EはE=E0・l/l0を用いて、
E=1.0 V×42 cm/100 cm=0.42 V と求められた。
・銀Ⅰ塩化銀電極を作成することができた。
以下の図3に完成した電極を示した。
 |
考察
銀Ⅰ塩化銀電極について
本実験では銀Ⅰ塩化銀電極を作成することに成功したが、デジタルテスターに表示された電流の値は、 -0.03Aと小さかった。私はこの理由に、紙やすりで銀線を研磨した際、研磨が甘かったことを考える。 研磨が甘かったが故に、露出した金属面が小さく、電流をよく通さなかった。したがって、-0.03Aという低い値が得られた。 以上が私の考察である。
分解電圧について
目的
電解液の種類と電極の種類を変えて、電解槽を組み立て、電流と槽電圧(浴電圧)の関係を調べる。 同じ電解液でも電流が流れ始める槽電圧(分解電圧)が違うことを確かめ、理論分解電 圧とのずれである過電圧について理解を深める。電流と電圧の関係を調べるボルタンメトリー の手法についても学ぶ。
使用器具
| 名称 | 個数 |
|---|---|
| 10mLビーカー | 3 |
| 秤量瓶 | 1 |
| ノギス | 1 |
| ガラス棒 | 1 |
| 洗瓶&イオン交換水 | 1 |
| ゼムクリップ | 1 |
| スパチュラ | 1 |
| 単三電池 | 1 |
| 電池ボックス | 1 |
| ミノムシコード(赤黒) | 各2本 |
| 電流計 | 1 |
| 電圧計 | 1 |
| 電子天秤 | 1 |
| 精密天秤 | 1 |
| ダブルクリップ | 2 |
| デジタルテスター | 1 |
| 抵抗尺(6V) | 1 |
| 検流計 | 1 |
| 紙やすり | 1 |
使用試薬
| 名称 | 式量 | 使用量 |
|---|---|---|
| 0.1mol/dm^3塩酸 | 36.46 | 10mL |
| 0.1mol/dm^3硫酸 | 98.08 | 10mL |
| 0.1mol/dm^3水酸化ナトリウム | 39.997 | 10mL |
手順
析出物質による過電圧の違い
理論分解電圧を求めた。アノードとカソードに白金を用いて 0.1 mol・dm-3 H2SO4、 0.1 mol・dm-3 NaOH、0.1 mol・dm-3 HCl の電流電位曲線を測定し、分解電圧を求めた。方眼紙へ のプロットは測定と同時に行った。理論分解電圧と実測値から過電圧を求めた。
金属の種類による過電圧の違い
理論分解電圧を求めた。アノードに白金、カソードに銅、亜鉛、黒鉛を用い、0.1 mol・dm-3 H2SO4 の電流電位曲線を測定し、分解電圧を求めた。理論分解電圧と実測値から過電圧 を求めた。白金以外の金属は測定直前に研磨後、0.1 mol・dm-3 HCl で前処理を行い、水で十分に 洗浄した。同様にカソードに白金、アノードに鉄、ニッケル、黒鉛を用いた場合について、0.1 mol・dm-3 NaOH の分解電圧を測定し、過電圧を求めた。
結果
・電極種類の異なる電流電位プロットを極性を間違えずに、正しく行うことができた。
プロットした図は以下の図4に示した。
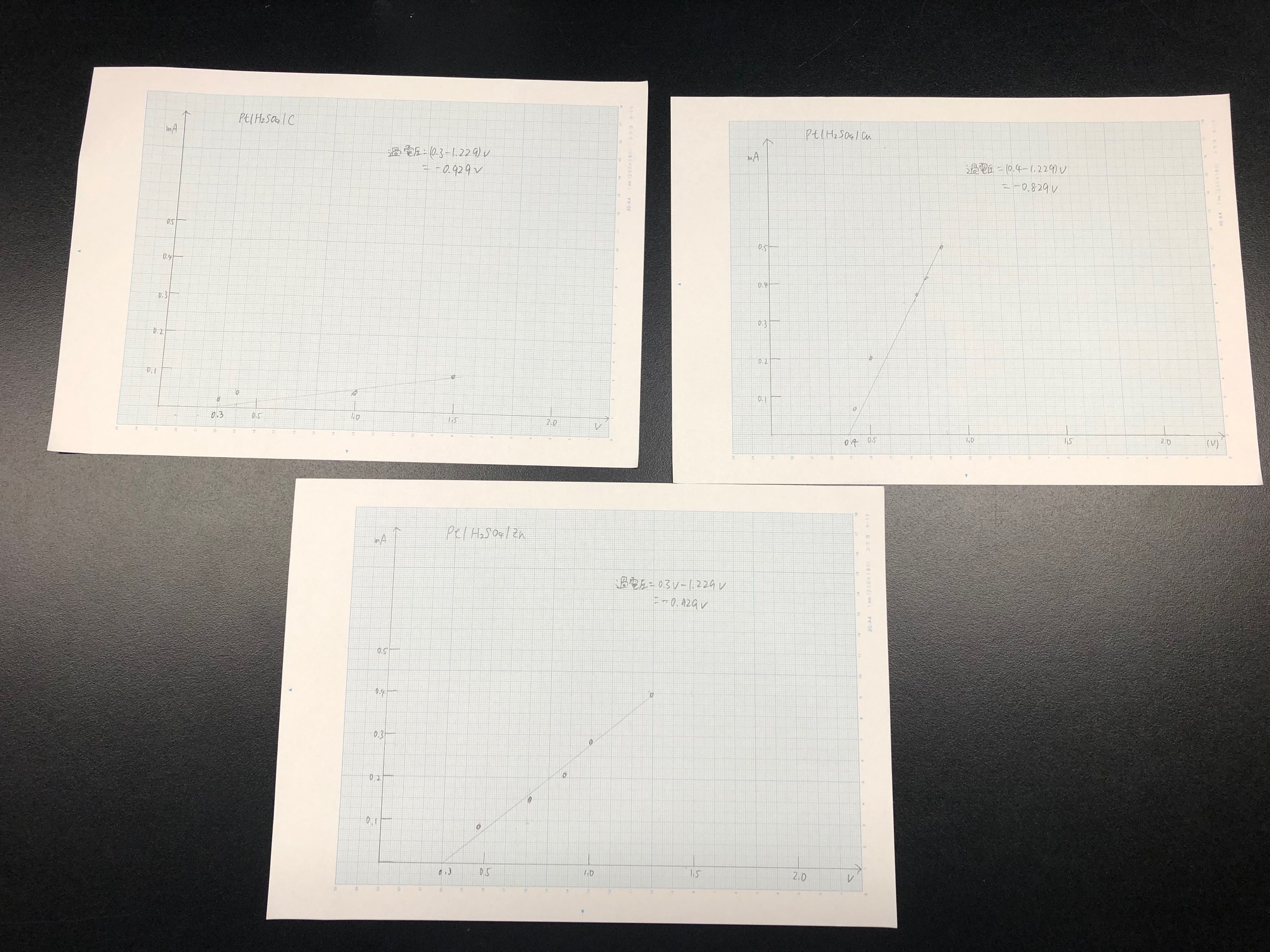 |
・電流電位プロットから過電圧を計算すると、
過電圧はそれぞれ、
Pt|H2SO4|C:0.3V-1.229V=-0.929V
Pt|H2SO4|Cu:0.4V-1.229V=-0.829V
Pt|H2SO4|Zn:0.3V-1.229V=-0.929V となった。
電極種類による違いを示すことができた。Pt|H2SO4|Cuのみが、他と比べ、高い過電圧となった。
・白金による電流電位プロットを正しく行うことができた。
プロットした図は以下の図5に示した。
 |
・電流電位プロットから過電圧を計算すると、
過電圧はそれぞれ、
Pt|0.1MNaOH|Pt:1.0V-1.229V=-0.229V
Pt|0.1MHCl|Pt:0.85V-1.229V=-0.379V
Pt|0.1MH2SO4|Pt:0.35V-1.229V=-0.879V となった。
ここから、析出物質により違いがあることがわかった。
考察
電極種類の異なる電流電位プロット
電流電位プロットから過電圧を計算すると、
Pt|0.1MNaOH|Pt:1.0V-1.229V=-0.229V
Pt|0.1MHCl|Pt:0.85V-1.229V=-0.379V
Pt|0.1MH2SO4|Pt:0.35V-1.229V=-0.879V となった。
このことから私は、酸性が強い物質ほど、過電圧が大きくなるのではないかと考察する。
参考文献
[1]野中ら:「技術レポート作成と発表の基礎技法(改訂版)」,コロナ社(2019)
[2]西脇永敏・伊東忍ら:「続 実験を安全に行うために (第 4 版)」, 化学同人 2020
[3]製品安全データシート 硫酸銅 内藤商店(株)