化学実験Ⅰ エネルギー化学実験 2.1電池の起電力
19512285 須藤誠
電池の起電力について
目的
銅電極側に硫酸銅水溶液、亜鉛電極側に硫酸亜鉛水溶液を塩橋であるセロハンチューブで隔ててそれぞれ入れ、
ダニエル電池を作り、基準電源を用いた電位差計でダニエル電池の起電力を確かめる。
理論
本実験で作成するダニエル電池は、次の電池式で表される。
Zn | 0.01 mol・dm⁻³ ZnSO₄ || 0.01 mol・d⁻³ CuSO₄ | Cu
そして負極及び正極の反応等は以下の通りである。
| 負極反応 | Zn²⁺ + 2e⁻ ← Zn | Eº = -0.7626V |
| 正極反応 | Cu²⁺ + 2e⁻ → Cu | Eº = 0.337V |
ここで理論起電力E'は、以下のネルンストの式から求められる。
E'=(CuのEº)-(ZnのEº)-(RT/nF){In([Zn²⁺][Cu])/([Cu²⁺][Zn])}
この時[Zn²⁺]と[Cu²⁺]は互いに同じ物質量であるので、
In([Zn²⁺][Cu])/([Cu²⁺][Zn])は0となる。よって、Eºのみで理論起電力は考える事になる。
そうすると理論起電力E'は、次にように求められる。
E'=(CuのEº)-(ZnのEº)=0.337V-(-0.7626V)=1.0996V
使用器具及び機器
以下の表2に、本実験での使用器具及び機器を示す。
| 使用器具及び機器 | 規格 | 個数 |
|---|---|---|
| ディスポカップ | 10 ml | 2 |
| ケミカルスポイト | 2 ml | 1 |
| 洗瓶(イオン交換水350 mL入り) | 500 ml | 1 |
| スパチュラ | - | 2 |
| セロハンチューブ | - | 1 |
| みの虫コード | 白・黒・赤 | 白:4, 黒:3, 赤:2 |
| 検流計 | - | 1 |
| 抵抗尺 | 6V | 1 |
| 乾電池 | 単三型 | 2 |
| 乾電池 | 9V型 | 2 |
| セロハンテープ | - | 1 |
| 電池ボックス | - | 1 |
| 電池スナップ | - | 2 |
| ブレッドボード | EIC-1202B | 1 |
| OPアンプ | アナログデバイセズ・OP275GP | 1 |
| レギュレータ | IC.LM78L05ACZFS | 1 |
| 金属皮膜抵抗 | 1kΩ | 1 |
| 金属皮膜抵抗 | 3.9kΩ | 1 |
| ジャンプワイヤー | - | 9 |
| 上皿電子天秤 | - | 1 |
| プラスドライバー | - | 1 |
| ゼムクリップ | - | 4 |
| ノギス | - | 1 |
使用試薬
以下の表3に、本実験での使用試薬を示す。
| 使用試薬 | 式量 | 使用量 [g] |
|---|---|---|
| 硫酸銅五水和物 | 249.68 | 0.01 |
| 硫酸亜鉛 | 286.5 | 0.03 |
実験操作
(1)まず、テキストや見本を参考にしながら基準電源を作成した。
(2)作成した基準電源を用いて、以下の回路図に従うように電位差計を作成して抵抗尺を較正した。
なお、図中のl₀[cm]は検流計の針が0を示すときの抵抗尺の長さである。
 |
| 図1.電位差計の回路図 |
(3硫酸銅五水和物を0.01g取って、5mlに調整した。
(4)硫酸亜鉛七水和物を0.03g取って、15mlに調整した。
(5)セロハンチューブを用いて、二つの溶液を区切りながらそれぞれの溶液を一つのディスポカップに入れた。
(6)銅電極を硫酸銅水溶液側に、亜鉛電極を硫酸亜鉛水溶液側にそれぞれ入れた。
(7)以下の回路図に従うように回路を組み、ダニエル電池の起電力を測定した。
なお、図中のl[cm]はダニエル電池の場合の、検流計の針が0を示す時の抵抗尺の長さである。
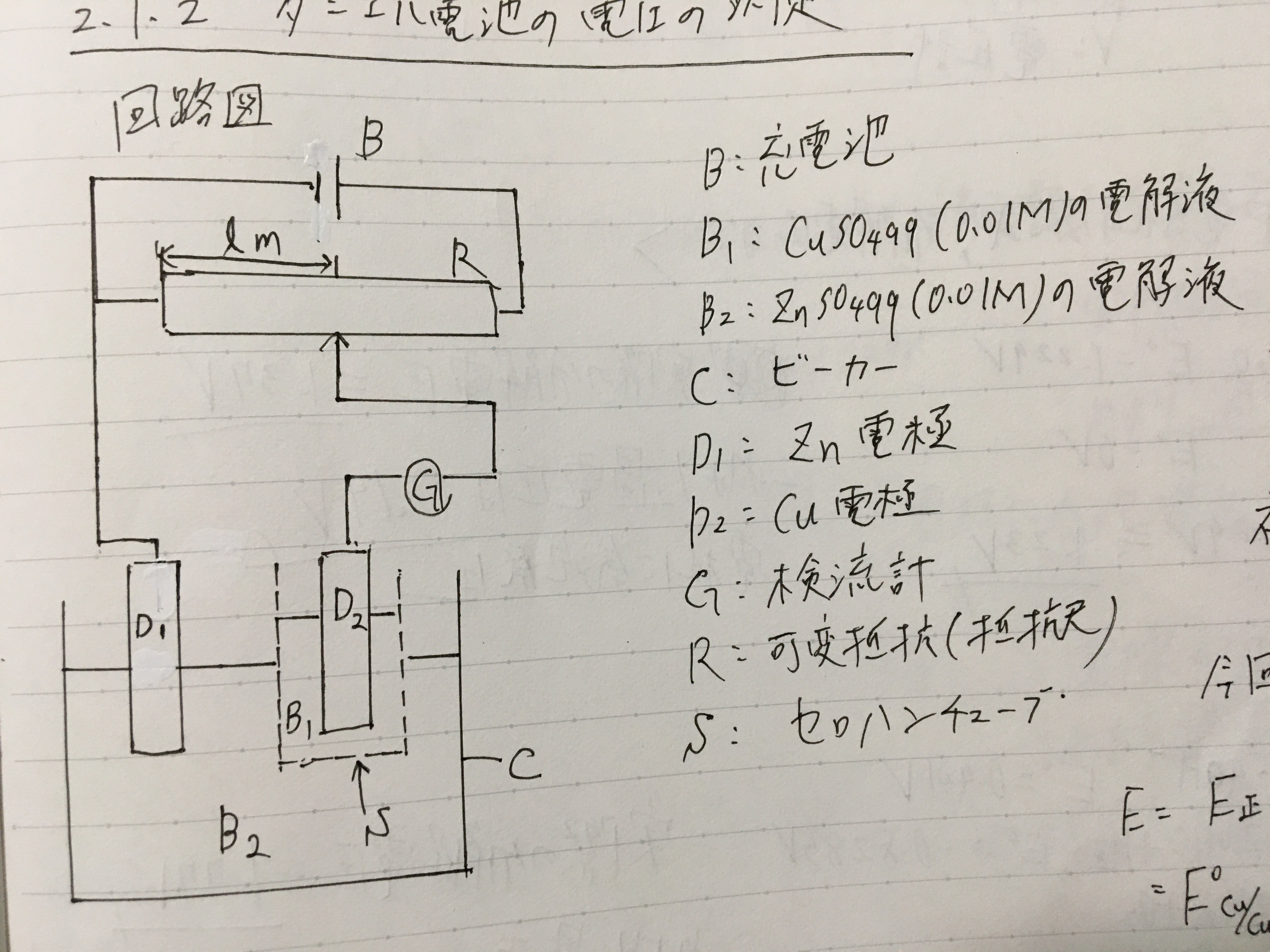 |
| 図2.ダニエル電池の回路図 |
結果
基準電源を用いた場合の、検流計の針が0を示すときの抵抗尺の長さl₀[cm]は44.8cmだった。
その時の実際の回路等を以下の写真で示す。
 |
| 写真1.実際に組んだ回路 |
ダニエル電池を用いた場合の、検流計の針が0を示すときの抵抗尺の長さl[m]は18.5cmだった。
本来であれば基準電源の時と同じぐらいの長さになっていなければならないので、
何か実験操作でミスをしたのだと考えられた。
また、l₀[cm]は44.8cm、l[m]は18.5cmとそれぞれ求められたので、ダニエル電池の起電力の実測値Eは
基準電源の電圧をE₀とし、E₀=1.0Vとすれば
E=E₀×(l/l₀)=1.0V×(18.5cm/44.8cm)=0.4129V
と求められた。
考察
なぜダニエル電池の起電力の実測値は低かったのか?
本実験で求めたダニエル電池の起電力の実測値は0.4129Vと、理論起電力の1.0996Vよりもはるかに低かった。
これは、分極によるものだと考えられる。「実験操作」で一つのディスポカップ内にセロハンチューブで区切って
2種類の溶液を入れた時、セロハンチューブ内に硫酸亜鉛水溶液が入り込んでしまった事があった。
ケミカルスポイトでセロハンチューブ内の硫酸亜鉛水溶液は出来る限り取り除いたが、多少残ってしまったために
硫酸銅水溶液と硫酸亜鉛水溶液が直接混ざってしまい、分極が起こってしまったと考えられる。
参考文献
(1)辰巳 敬ら: 「化学」, 数研出版株式会社(2017)